
21.(14分)
(1)中和热的测定实验(如下图)。
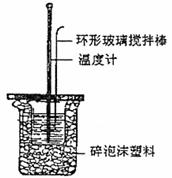
①量取反应物时,取50mL 0.50mol·L-1的盐酸,还应加入的试剂是 (填序号)。
A.50mL 0.50mol·L-1NaOH溶液
B.50mL 0.55mol·L-1NaOH溶液
C.1.0gNaOH固体
②在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
③若用50mL 0.50mol·L-1醋酸溶液代替上述盐酸测定中和热,所得数据 。(填“偏大”或“偏小”或“不变”)
(2)硫酸铜晶体(CuSO4·xH2O)结晶水含量的测定实验。
①称量一定质量硫酸铜晶体后,加热脱结晶水时用到的仪器主要有:玻璃棒、三角架、坩埚钳、泥三角和 。
②实验中要将坩埚放在干燥器中冷却,其主要目的是 。
③若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后坩埚与无水硫酸铜的质量为m2,则晶体CuSO4·xH2O中x= (写表达式)。
④如果实验中加热温度过高,固体颜色变黑,则测定结果会 (填“不变”或“偏高”或“偏低”)
20.对于氮元素形成的单质,除了已知的氮气,科学家还先后研究出了N4、N60、N70、高聚氮等。其中高聚氮是在高压下通过氮气的聚合生成的,晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构:N4分子结构如下图所示。已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以下信息和数据,下列说法正确的是 ( )

A.N4、N60、N70、高聚氮均是分子晶体
B.N4、N60、N70、高聚氮互为同素异形体
C.1molN4气体转变为N2将吸收882kJ热量
D.N4沸点比N70低
19.实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:
I2(aq)+I-(aq) I3-(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是 ( )
I3-(aq)上述平衡体系中,I-3的物质的量浓度c(I3-)与温度T的关系如下图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是 ( )
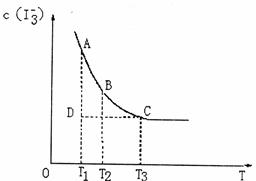
A.该反应的正反应是放热反应
B.A点与C点的化学反应速率vA<vC
C.在反应进行到D点时, v正<v逆
D.A点与B点相比,B点的c(I2)大
18.CaC2和MgC2都是离子化合物,下列叙述中正确的是 ( )
A.CaC2和MgC2与水反应都生成乙炔
B.C2-2的电子式是: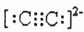
C.CaC2在水中以Ca2+和C2-2形式存在
D.MgC2的熔点低,可能在100℃以下
17.将质量分数为a%的稀硫酸蒸发掉一定量水,使其质量分数为2a%,如果用c1和c2分别表示溶液蒸发前和蒸发后的物质的量浓度,则c1与c2的关系是 ( )
A.c1=2c2 B.c2=2c1 C.c2>2c1 D.c2<2c1
16.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液。由于浓度不同而能发生不同氧化还原反应的是 ( )
A.①③ B.③④ C.①② D.①③④
15.下列叙述中正确的是 ( )
①CO2是由极性键构成的非极性分子
②由于氢键的作用,水的稳定性强于硫化氢
③离子晶体一定含有离子键,分子晶体中一定含有共价键
④在晶体中只要有阴离子就一定有阳离子
⑤原子晶体的熔点一定比金属晶体的高,分子晶体的熔点一定比金属晶体的低
⑥二氧化硅和氯化钠熔化时所克服的化学键类型不同
A.①④⑤ B.②④⑤ C.①④⑥ D.①③⑥
14.如下图所示元素周期表前四周期一部分,关于元素X、Y、Z、W的叙述正确的是( )
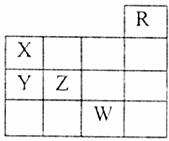
①X、Y的最高价氧化物的水化物的酸性为Y<X
②Y、Z的气态氢化物的稳定性Y<Z
③W的单质常温下呈液态,可与铁粉反应
④W的原子序数比Z大9
⑤W所在的周期中包含有32种元素
⑥标准状况下,22.4LR单质所含的原子数为2NA
A.只有③⑥ B.①②⑤ C.①②③ D.①②③④
13.在溶液中加入足量的Na2O2后仍能大量共存的离子组是 ( )
A.NH4+、Ba2+、Cl-、NO3- B.K+、AlO2-、Cl-、SO42-
C.Ca2+、Mg2+、NO3-、HCO3- D.Na+、Cl-、CO32-、SO32-
12.下列离子方程中错误的是 ( )
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO2-4=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应: NH4++HCO3-+2OH-=NH3·H2O+CO32-+H2O
C.苯酚钠溶液中通入过量CO2:
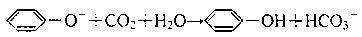
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+2Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com