
4.下列对实验现象的预测不正确的是
A.向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
B.向氢氧化铁胶体中滴加盐酸至过量,开始有沉淀出现,后来沉淀又溶解
C.向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
D.向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入过量NaOH溶液,又变浑浊
3.NA代表阿伏加德罗常数。下列说法中,不正确的是
A.2.8g 乙烯与丙烯的混合物中含碳原子的数目为 0.2NA
B.25℃时,l L pH=13的Ba(OH)2 溶液中含有OH―的数目为0.1 NA
C.1 mol C30H62 分子中含有共价键的数目为 91 NA
D.标准状况下,NO和 O2各11.2 L 混合,所得混合气体的分子总数为 0.75 NA
2.化学是以实验为基础的学科,化学实验设计和操作中必须十分重视师生的安全问题和环境保护问题。下列操作方法不正确的是
A.制氧气时排水法收集氧气后出现倒吸现象,立即松开试管上的橡皮塞
B.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
C.在气体发生装置上直接点燃乙炔气体时,必须先检验乙炔气体的纯度
D.给试管中的液体加热时不停移动试管或加入碎瓷片,以免暴沸伤人
1.下列有关化工生产的叙述中正确的是
A.将煤液化、气化,有利于提高燃料的燃烧效率
B.侯氏制碱法,向饱和NaCl溶液中先通入CO2再通入氨气制取纯碱
C.电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等
D.工业生产硫酸中,建立高烟囱可以降低地面SO2的浓度,减少空气污染
26.(10分)往含0.2mol NaOH和0.1 mol Ca(OH)2的混合溶液中持续稳定地通入CO2气体0.5mol。请以CO2的量为横坐标,以溶液中离子的总量为纵坐标,画出离子总量随CO2加入量变化的折线图,并请写出该过程中所有反应的离子方程式。(不计弱电解质的电离和盐的水解)
(1)关系图如下
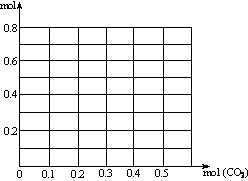
(2)该过程中所有反应的离子方程式为:
25.(14分)化合物A、B、C、D 均为饱和一元含氧衍生物,下图中涉及的7个转化均为中学化学中常见反应。请据此回答:
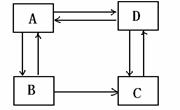
(1)B的分子中一定含有的官能团是 (填名称),
C的分子中一定含有的官能团是 (填结构简式);
(2)指出反应类型:A→B ,C→D ;
(3)A的一种同系物A1不能实现上述转化,且A1是该类物质中相对分子质量最小的。则A1的结构简式为__ ___;
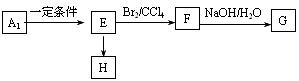
(4)已知A1有如图转化关系,其中H为高分子化合物,则H的结构简式为 ,写出F→G转化的化学方程式 。
24.(8分)在200mL1mol·L-1的NaHCO3溶液中,加入一定量的单质或化合物X,恰好使其转化为只含Na2CO3溶质的溶液,实现转变的物质X有多种,请将各种X物质填入下表(要求其中至少包含一种单质)。
|
编号 |
1 |
2 |
3 |
4 |
|
X的化学式 |
|
|
|
|
|
加入X的质量(g) |
|
|
|
|
23.(14分)置换、化合、复分解是三种基本反应类型,而H2O在各种化学反应中扮演不同的“角色”。下面围绕水的各反应全部来自现行教材。下列问题所涉及的答案可能有多种,只需答出一种情况即可:
⑴H2O作反应物的置换反应
①__ __(填化学式)和H2O能在加热或高温条件下进行;
|
⑵H2O作生成物的置换反应:
加热条件下的置换,其反应物可是_________________(填化学式);
⑶水解反应
①气体产物可用焊接金属,其化学方程式:____________________________;
②1分子的___________(填名称)水解之后有2分子同种物质生成;
⑷化合反应:
①有碱金属元素参与的三物质化合,其化学方程式:____________________;
②有电子得失且三物质参与的化合,其产物的颜色与状态是_____________。
22.(10分)A、B、C、D、E 5瓶溶液,分别是AlCl3、BaCl2、NaHSO4、K2CO3、AgNO3中的一种。已知:①A与B反应有气体产生;②B与C反应有沉淀生成;③C与D反应有沉淀生成;④D与E反应有沉淀生成;⑤A与E反应有气体生成;⑥在②、③反应中生成的沉淀是同一物质。请填写下列空白:
⑴A是____________,B是____________,D是______________;
⑵向C溶液中逐滴滴加过量稀氨水,在整个过程中出现的现象是_____________;
⑶将0.1mol/L的E溶液与0.1mol/L的Ba(OH)2溶液按下表中甲、乙、丙、丁、戊不同方式混合:
|
|
甲 |
乙 |
丙 |
丁 |
戊 |
|
0.1mol/L的Ba(OH)2溶液的体积/mL |
10 |
10 |
10 |
10 |
10 |
|
0.1mol/L的E溶液的体积/mL |
5 |
10 |
15 |
20 |
25 |
①按丁方式混合后,所得溶液显________(填“酸”、“碱”、“中”)性;
②写出按乙方式混合时,反应的离子方程式为___________________________;
③25℃时,按甲方式混合后,所得溶液的pH为________。
21. (4分)下列实验操作或对实验事实的叙述中存在错误的是 (填序号)。
A.用50mL酸式滴定管准确量取25
|
|
B.测定硫酸铜晶体的结晶水时,将灼烧硫酸铜晶体的坩埚放在空气中冷却,然后称量;
C.中和热的测定所需的玻璃仪器有烧杯、温度计、量筒;
D.实验室中进行下列实验需水浴加热:
①苯的硝化反应 ②葡萄糖的银镜反应 ③乙酸乙酯的制备
E.配制1mol·L-1的NaOH溶液时,下列操作会造成所配溶液浓度偏低:
①溶解后烧杯未多次洗涤 ②定容时仰视刻度线 ③容量瓶中原有少许蒸馏水
F.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com