
1.生活中常用到一些化学知识,下列分析中正确的是 ( )
A.医疗上可用硫酸钡作x射线透视肠胃的内服药,是因为硫酸钡不溶于水
B.某雨水样品放置一段时间后pH由4.68变为4.00,是因为水中溶解的CO2增多
C.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
D.加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
22.(10分)将15.6g Na2O2与2.7 gA1粉混合后,投入足量的水中(设等产生的气体全部放出)
(1)Na2O2与水反应的化学方程式为 。15.6gNa2O2在该反应中转移电子的物质的量为 mol。
(2)反应结束时生成气体的体积在标准状况下为 L。
(3)向反应后的溶液中加入 mL 2mol/L盐酸时沉淀的质量最大。
(4)取ag Na2O2与A1粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为VL,则V的取值范围是 (用含a的代数式表示,结果可不化简)
21.(8分)A、B、C、D、E为含同一种元素的常见物质。C物质只由一种元素组面,在1个C分子中形成共价键的电子数与分子中所含电子数之比为3:7。C、E均可与氧气在一定条件下反应生成A。请回答以下问题:
(1)常温下将气体B通入水中发生反应,生成A和D,则D的化学式为 。
(2)E分子的空间构型是 。
(3)写出工业合成E反应的化学方程式 。
(4)D和E生成的化合物在某温度下加热分解,同时生成两种氧化物。且在此过程中,若有0.5mo1该化合物完全反应,转移电子数为2mol。写出该反应化学方程式 。
20.(12分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物完成下列各题:
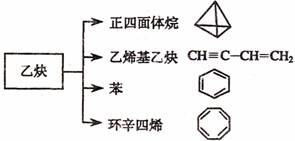
(1)写出实验室制中取乙炔的化学方程式
(2)正四面体烷的分子式为 ,其 二氯取代产物有 种
(3)关于乙烯基乙炔分子的说法错误的是:
A.能使酸性 KMnO4 溶液褪色
B.1 摩尔乙烯基乙炔能与 3 摩尔 Br2 发生加成反应
C.乙烯基乙炔与乙炔互为同系物
D.等物质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量相同
(4)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:
(5)写出苯与溴发生取代反应的化学方程式:
19.(9分)
(1)在一定的温度下,在一个密闭容器中充入x mol的SO2和y mol和O2发生反应,达到平衡状态时,SO2的转化率为a%,O2的转化率为b%。如果a=b则x:y ,a>b则x: y 。
(2)如果在一个容积可变密闭容器中,达到平衡状态时SO2和O2和SO3物质的量浓度的比是2:0.8:2,此时向容器里将SO2、O2和SO3各充入1mol,保持压强不变,再达到平衡时,SO2的转化率 。(填增大、减少、不变)
(3)一定温度下,在体积不变的密闭容器中,充入平均相对分子质量为48的SO2和O2的组成的混合气体,达到平衡时,混合气体的平均相对分子质量为60,则SO2的转化率是 。
18.(12分)三氯化铁是中学化学实验室中常用的化学试剂。某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,该同学设计的实验装置如图所示,其实验步骤如下:A中放有废铁屑,烧杯中盛有过量的H2O2溶液,实验时打开a,关闭b,从分液漏斗内向A中加过量的盐酸,此时溶液呈浅绿色,再打开b进行过滤,过滤结束后,取烧杯内溶液倒入蒸发皿加热,蒸发掉部分水并使剩余HNO3分解,再降温结晶得FeCl3·6H2O晶体。填写下列空白:
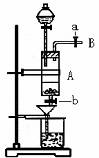
(1)收集导管B处的气体可采用的方法是 。
滴加盐酸时,发现反应速率较之盐酸与纯铁粉反应要快,其原因是 。
(2)烧杯内放过量稀HNO3溶液的原因是 ,
发生反应的离子方程式是 。
(3)整个实验过程中,弹簧夹a都必须打开,除为排出产生的气体外,另一个目的是
。
(4)将烧杯内溶液用蒸发、浓缩、再降温结晶法制得FeCl3·6H2O,而不用直接蒸干的方法来制得晶体的理由是 。
17.(11分)下图是一些物质的转化关系,方框中的字母代表一种物质,其中X、Y、D、G是空气成分。B是有颜色的气体,且一些转化的生成物和反应的条件略去了。
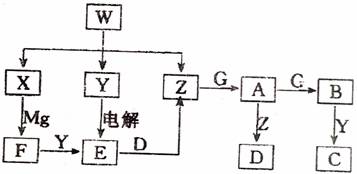
请回答下列问题:
(1)W的化学式是 ,X的电子式是 ,用电子式表示Y中化学键的形成过程 。
(2)写出下列反应的化学方程式:
X-F 。
Z-A 。
16.用铝热法还原下列物质,制得金属各1摩尔,消耗铝最多的是 ( )
A.MnO2 B.Fe2O3 C.Cr2O3 D.V2O5
第Ⅱ卷(共62分)
15.将10mL 0.1mol ·L-1氨水与10mL 0.2mol·L-1盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是 ( )
A.c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.c(C1-)>c(NH4+)>c(H+)>c(OH-)
C.c(NH4+)>c(C1-)>c(OH-)>c(OH))
D.c(H+)>c(C1-)>c(NH4+)>c(OH-)
14.下列叙述正确的是 ( )
A.当温度不变时,在纯水中加入强碱溶液不会影响水的离子积常数
B.溶液中[H+]越大,pH值也越大,溶液的酸性就越强
C.液氯虽然不导电,但溶解于水后导电情况良好,因此,液氯也是强电解质
D.pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com