
14.通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列事实解释正确的是 ( )
|
|
现象 |
解释 |
|
A |
KI淀粉溶液中通入Cl2,溶液变蓝 |
Cl2能与淀粉发生显色反应 |
|
B |
在潮湿的空气中,铁制品易生锈 |
铁、杂质碳和水膜形成了原电池 |
|
C |
某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 |
说明该溶液中含有SO42- |
|
D |
向盐酸中加入浓硫酸时产生白雾 |
说明浓硫酸具有脱水性 |
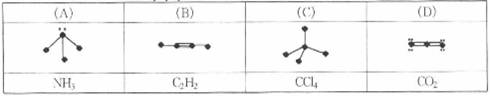
13.下列各图中的大黑点代表原子序数从1~18元素的原子实(原子实是原子除最外层电子 后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键。下列各图表示的结构与化学式一定不相符的是 ( )
12.近日来,沈城“巨能钙”事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部已开始加紧调查“巨能钙”事件。下列有关说法错误的是 ( )
A.双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害
B.H2O2、Na2O2中都存在非极性共价键
C.H2O2既有氧化性,又有还原性,与KMnO4反应时表现H2O2的还原性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,和SO2不同
11.纳米是长度单位,1纳米等于1×10-9m,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜”的有关叙述正确的是 ( )
A.常温下“纳米铜”比铜片的金属性强,反应时反应速率快
B.常温下“纳米铜”比铜片更易失电子,反应时反应速率快
C.常温下“纳米铜”与铜片的还原性不同
D.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快。
10.下列关于热化学反应的描述中正确的是 ( )
A.盐酸和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和 热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则二氧化碳分解的热化学方程式为:
2CO2(g) =2CO(g)+O2(g) ΔH=2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
9.在给定条件下,下列加点的物质在化学反应中完全消耗的是 ( )
A.标准状况下,将1g铝片投入20mL 18.4mol/L的硫酸中
B.常温下,向100mL 3mol/L的硝酸中加入6.4gCu
C.在适当温度和催化剂作用下,用2mol SO2和1mol O2合成SO3
D.将含有少量H2O(g)的H2通入足量Na2O2容器中并不断用电火花点燃
8.下列说法,其中正确的是 ( )
A.液面均在“0”刻度时,50ml碱式滴定管和25ml碱式滴定管所盛溶液的体积之比为2:1
B.一种元素可能有多种氧化物,但一种化合价只对应一种氧化物
C.有些化学反应不属于化合、分解、置换、复分解反映中的任何一种反应
D.22.4LCO2与22.4LCO所含氧原子数目之比为2:1
7.以下说法中,符合科学规律的是 ( )
①改变核外电子数可使原子与分子间互相转化
②改变核内中子数可使同一元素的不同核素间相互转化
③改变核内质子数可使同一元素的离子间相互转化
④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
A.①③ B.②④ C.①② D.①②③④
6.下列各组离子在指定溶液中可能大量共存的是 ( )
①无色溶液中:K+、Cu2+、Na+、MnO4-、SO42-
②水电离产生的c(H+)=1×10-12mol·L-1的溶液中:Mg2+、SO42-、NO4-、Cl-
③加入Al能放出H2的溶液中:HCO3-、Na+、NO3-、Cl-
④能使pH试纸变为蓝色的溶液中:S2-、Na+、SO32-、Cl-
⑤含有大量Fe3+的溶液中:K+、Na+、AlO2-、SO42-
A.②④ B.②③ C.①⑤ D.①④
5.下列叙述中正确的是 ( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除短周期外,其他周期均有18种元素
C.在同一周期中,ⅠA族比ⅡA族的单质与水反应更剧烈
D.在ⅠA族中,单质的熔、沸点随着原子半径的增大而逐渐升高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com