
1.原子核对核外电子的吸引力
25.(8分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
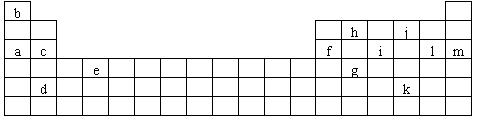
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
24.(11分)通常状况下,X、Y和Z是三种气态单质。X的组成元素是第三周期原子半径最小的元素(稀有气体元素除外);Y和Z均由元素R组成,反应Y+2I-+2H+ I2+Z+H2O常作为Y的鉴定反应。
(1)Y与Z的关系是(选填字母)_______。
a.同位素 b.同系物 c.同素异形体 d.同分异构体
(2)将Y和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法______________________________________________________。
(3)举出实例说明X的氧化性比硫单质的氧化性强(用化学方程式表示)___________。
(4)气体(CN)2与X化学性质相似,也能与H2反应生成HCN(其水溶液是一种酸)。①HCN分子中含有4个共价键,其电子式是
___________________________________。
②KCN溶液显碱性,原因是(用离子方程式表示)
_____________________________。
23.(8分)CO和O2在有催化剂和加热条件下,很容易发生下列反应:
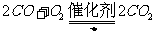 。现针筒内贮有200mLCO2、CO、O2的混合气体,(标准状况)。假设其中CO2为xmL,CO为ymL,其余为O2(足量)
。现针筒内贮有200mLCO2、CO、O2的混合气体,(标准状况)。假设其中CO2为xmL,CO为ymL,其余为O2(足量)
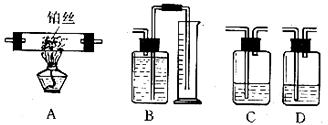
请回答下列问题:
(1)从针筒压出的气体,从左到右流过的装置连接顺序应该是(用A、B、C、D……表示)_______________
(2)吸收瓶C和D中所盛的吸收溶液是足量的__________溶液,装置B中所盛可以是___________。
(3)实验完毕后,在装置B量筒中液体的体积约为_______________mL(用含x,y的式子表示)。
(4)在(1)装置中,从左数第一个吸收瓶中产生的CaCO3质量约为_________mg;第二个吸收瓶产生的沉淀质量约为________mg。(用含x或y的式子表示)。
(5)如果第一个吸收瓶[在(1)装置中]中得到200 mg CaCO3沉淀,第二个吸收瓶得到150mg沉淀,则原混合气体中含CO2的体积为________ mL,;含O2的体积为________ mL。
22.下列反应中,一定有白色沉淀生成的是 ( )
①向久置的Na2SO3溶液中加入BaC12溶液,再加入稀盐酸;
②向Na2CO3溶液中加入酸性CaC12溶液;
③向Na2CO3溶液中通入C12,再滴加BaC12和稀盐酸;
④向Na2CO3溶液中加入稀HNO3后再加入BaC12溶液;
⑤H2S通入Cu(NO3)2溶液中
A.①③④ B.①③④⑤ C.①②③④ D.②③④
第Ⅱ卷(主观题,共56分)
21.X元素的1个原子转移2个电子到Y元素的2个原子中去,形成化合物Z,下列说法不正确的是 ( )
A.Z具有较高的熔沸点 B.Z可能易溶于水
C.Y形成Y2-离子 D.Z晶体中X离子与Y离子之比为1:2
20.有一瓶Na2SO3溶液,可能部分被氧化。某同学用此溶液进行如下实验:取少量溶液,滴入硝酸钡溶液产生白色沉淀,再加入足量稀HNO3,充分振荡后仍有白色沉淀,对此实验下列结论不正确的是 ( )
A.Na2SO3已部分氧化
B.加入硝酸钡溶液生成的沉淀一定含BaSO4
C.加入HNO3后不溶沉淀一定为BaSO4
D.此实验不能确定Na2SO4是否部分氧化
19.CaH2是种离子化合物,它溶于水后放H2,下列判断正确的是 ( )
A.CaH2中的氢离子的电子排布与Ne相同
B.溶于水呈酸性
C.CaH2中氢离子半径比锂离子半径大
D.与水反应CaH2被还原
18.下列叙述中错误的是 ( )
A.实验室可用浓H2SO4跟金属硒化物反应制取H2Se
B.H2SeO3中的Se,既具有氧化性,又具有还原性
C.硒酸钠的化学式为Na2SeO4
D.碲跟氢气化合比碘跟氢气化合更困难
17.以下叙述正确的是 ( )
A.原子的最外层电子数等于该元素所在的族序数,也等于价电子数
B.同主族元素从上到下,含氧酸或无氧酸的酸性均减弱
C.既能跟酸反应,又能跟碱反应的化合物,一定是两性氢氧化物
D.次外层为2个电子的元素一定是第二周期元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com