
3.下列关于钠及化合物用途的说法错误的是 ( )
A.钠和钾的合金可用作原子反应堆导热剂
B.小苏打在医疗上可用作治疗胃酸过多的药剂
C.金属钠可将钛从它的氯化物溶液中置换出来
D.皮肤上不慎沾有酸性物质可用稀小苏打溶液洗涤
2.下列关于碱金属的叙述不正确的是 ( )
A.熔沸点从锂到铯逐渐降低
B.随核外电子层数递增,单质密度依次增大
C.原子最外层电子数都为1
D.随核电荷数递增,金属性逐渐增强
1.下列反应属于氧化还原反应的是 ( )
A.NH4HCO3 NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
B.P2O5+3H2O 2H3PO4
C.H2SO4+BaCl2 BaSO4↓+2HCl
D.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
24.(9分)水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、
Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如图所示:
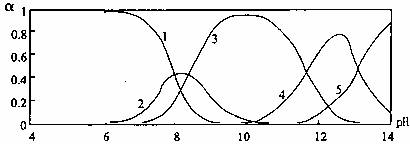
[1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,
5表示Pb(OH)42-]
(1)Pb(NO3)2溶液中,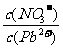 2(填“>”、“=”或“<”=,往该溶液中滴入硫酸铵溶液后,
2(填“>”、“=”或“<”=,往该溶液中滴入硫酸铵溶液后,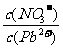 增加,其原因是
;
增加,其原因是
;
(2)往Pb(NO3)2溶液中加入NaOH溶液,pH=9时,主要反应的离子方程式为 ,pH=12时,溶液中存在的阴离子(除NO3-、OH-外)为 ;
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验测得铅离子及相关离子浓度变化如下表:
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其它离子的去除效果最好的是 ;
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+
E2Pb(s)+2H+,则脱铅的最合适pH范围为 (填代号)。
A.4~5 B.6~7 C.9~10 D.11~12
23.(9分)在一个容积固定的反应容器中有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应:

A、B、C、D、E、F的起始加入量分别为2 mol、1 mol、0 mol、X mol、Ymol、Zmol,两边反应达平衡后,隔板恰好在正中间位置。
(1)恒温时,若向左边容器中充入0.3 molHe,则右边容器内的平衡向 移动(填“左”、“右”或“不”);
(2)恒温时,若向左边容器中通入的不是He,而是2 molA和1 molB的气体,与原平衡相比,C的体积分数 (填“增大”、“减小”或“不变”,下同)右边容器中气体平均相对分子质量 ;
(3)恒温时,在(2)题的平衡体系中,若向左右两容器中同时再各注入1 molHe,平衡后与(2)题的原平衡体系相比,下列说法正确的是 (填序号)。
A.C、F的浓度都不变 B.B的转化率、F的分解率均增加
C.A、D物质的量都增加了 D.A、B、C、D、E、F物质的量都不变
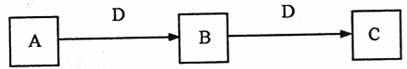
22.(8分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化的关系如下图所示(部分产物已略去):
请按要求回答下列问题:
(1)若D为强氧化性单质,则A可能是 (填序号);
a.S b.N2 c.Na d.Mg e.Al
(2)若D为用途极广的某金属单质,向C的溶液中滴加AgNO3溶液,产生不溶于稀硝酸的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量的D,理由是 ;
(3)若D为强电解质,A和C在溶液中反应生成的B是白色絮状沉淀,则B的化学式为 ,A和C反应的离子方程式是 。
21.(10分)现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大。A、D同主族,C、E同主族,D、E、F同周期。A、B的原子最外层电子数之和与C原子的最外层电子数相等。A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态。A能分别与E、F形成电子总数相等的气体分子。
请问答下列问题:
(1)A~F六种元素原子,原子半径最大的是 (填对应的元素符号,下同);
(2)A与B两种元素组成一种阳离子,该离子的检验方法为 ;
(3)C、D两种元素组成的化合物中,既含有离子键,又含有非极性共价键,该化合物的电子式为 ;
(4)E、F两种元素中非金属性较强的是 ,能够证明这一结论的化学事实是 。
20.(11分)Na2CO3是一种重要的化工原料,某学生甲拟在实验室中测量Na2CO3的纯度。他利用图1中给出的仪器设计了图2所示的装置(本题装置图中所用塞子均未画出;杂质不参与反应),其中M容器中盛有Na2CO3样品10.0g,分液漏斗盛有稀硫酸,N容器内为碱石灰固体。他利用碱石灰的增重来求算Na2CO3的纯度。
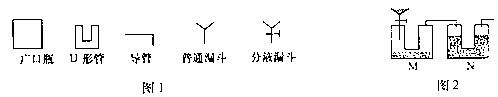
(1)学生乙认为,按学生甲设计的装置进行实验,存在明显缺陷,其中导致测定结果偏低的是 ;
(2)学生乙对学生甲设计的实验装置进行了完善(如图3)。实验室中可供选择的药品:Zn、浓H2SO4、稀H2SO4、NaOH溶液、碱石灰、CaCO3、水。请回答下列问题:
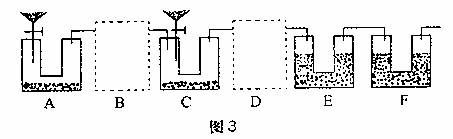
①B、D虚框内是否需要添加装置,若需要,在相应虚框内画出装置图(并注明药品);若不需要,在相应虚框内打“×”;
②A装置中分液漏斗内液体为 ,U型管内药品为 ;
装置F的作用为 ;
③如果B、D内部不设计任何装置而直接连通ACE,则实验结果将 (填“偏高”、“偏低”或“无影响”);
④如果实验后E装置质量增重3.96g,则该Na2CO3试样的纯度为 。
19.(7分)铁及其化合物之间的相互转化可用下式表示:
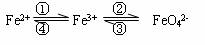
回答下列有关问题:
(1)Fe与过量稀硫酸反应可以制取FeSO4。若用反应所得的酸性溶液实现上述①的转化,要求产物纯净。可选用的试剂是 (选填序号);
a.Cl2 b.Fe c.HNO3 d.H2O2
(2)上述转化得到的硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S(CuFeS2中S为-2价)。
则下列说法正确的是 (选填序号);
a.从物质的组成来看,黄铜矿属于合金
b.反应中,所有铁元素均被还原
c.反应中,CuFeS2既作氧化剂又作还原剂
d.当转移1 mol e-时,有46 g CuFeS2参加反应
(3)高铁酸钾是一种新型、高效的绿色净水剂,其净水原理是 。
18.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 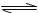 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中不正确的是 ( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如下图所示。下列说法中不正确的是 ( )
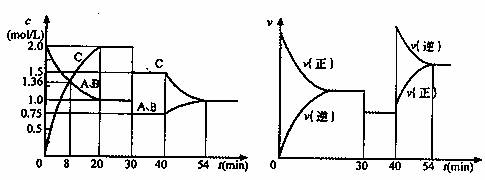
A.在30min时降低温度,40min时升高温度
B.8min前A的平均反应速率为0.08 mol·L-1·min-1
C.反应方程式中的x=1,正反应为放热反应
D.20min~40min间该反应的平衡常数均为4
第Ⅱ卷(非选择题 共54分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com