
7.关于Li、Na、K、Rb、Cs的叙述均正确的一组是 : ( )
①金属性最强的是铯 ②氧化性最强的是锂原子
③在自然界中均以化合态形式存在 ④密度按Li-Cs 顺序呈依次递增趋势
⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥它们的 氧化物都只有M2O和M2O2两种形式
⑦粒子半径:Rb+>K+>Na+, Cs>Cs+>K+, K>Na>Li
A.①②③④ B.④⑤⑥⑦ C.②⑥ D.①③⑤⑦
6.含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是: ( )
A.Na2S B.NaHS C.Na2S和NaHS D.NaOH和NaHS
5.某学生用化学知识解决生活中的问题,下列家庭小实验不合理的是: ( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验食盐中是否含碘酸钾(KIO3)
C.用纯碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
4. 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如下图,则下列判断错误的是: ( )
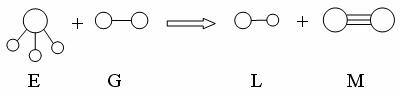
A.G是最活泼的非金属单质 B.L是极性分子
C.E能使紫色石蕊试液变蓝色 D.M化学性质活泼
3.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是: ( )
A.2.24LCO2中含有的原子数为0.3 ×6.02×1023
B.0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3 ×6.02×1023
C.5.6 g 铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×1023
D.4.5 g SiO2晶体中含有的硅氧键数目为0.3 ×6.02×1023
2.实验室保存下列药品的方法,正确的是: ( )
A.氢氟酸贮存在细口玻璃瓶里 。
B.浓硫酸盛放在广口瓶里,应当用磨口玻璃塞,不能用橡皮塞。
C.盛溴的试剂瓶里加一些水来防止溴挥发。
D.少量碱金属单质都保存在煤油中;液氯贮存在钢瓶里。
1.2008年9月25日,“神七”成功飞天,27日,宇航员翟志刚成功完成中国历史上的首次太空行走,从此,中国成为第三个独立掌握出舱活动技术的国家。宇航员出舱时呼吸所需氧气主要来自太空服中的呼吸面具。下列反应均能产生氧气,其中最适宜用于呼吸面具中供氧的反应是: ( )
A.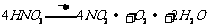
B.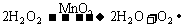
C.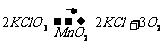 ↑
↑
D.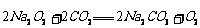
23.(8分)将15.6 g Na2O2与2.7 g Al粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为 ,15.6 g Na2O2在该反应中转移电子的物质的量为 mol.
(2)反应结束时生成气体的体积在标准状况下为 L。
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下放出气体的体积为V L,则V的取值范围是 (用含a的代数式表示,结果可不化简)。
22.(10分)早在1785年,卡文迪许在测定空气组成时,除去空气中的O2、N2等已知气体后,发现最后总是留下一个体积不足总体积1/200的小气泡。
1892年,瑞利在测定氮气密度时发现,从空气中得到的氮气密度为1.2572 g/L,而从氨分解得到的氮气密度为1.2508 g/L。两者相差0.0064 g/L。
有人认为:以上两种氮气很小的密度差别可能来源于实验误差,瑞利在多次试验中发现,从空气中得到的氮气密度总是比从氨分解得到的氮气密度略大。
瑞利和拉姆赛共同研究后认为:以上两个实验中的“小误差”可能有某种必然的联系,并预测大气中含有某种较重的未知气体。经反复实验,他们终于发现了一种化学性质极不活泼的新气体。
(1)瑞利根据什么坚持认为两种氮气很小的密度差别不可能来源于实验误差?_________。
(2)在瑞利和拉姆赛预测中的那种未知的气体密度比氮气的密度__________(选填“大”或“小”或“无法确定”)。
(3)某同学使用以下一些装置来模拟卡文迪许的实验:
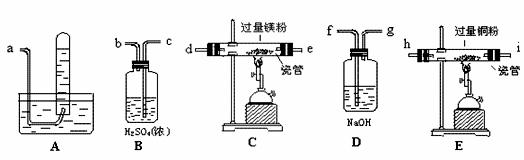
请将仪器连接的最佳顺序(按空气流向填各接口的编号)排列于右:→( )( )( )( )( )( )( )( )→a 。其中,D装置的作用是: ;E装置的作用是: ;写出在C装置中发生化学反应的方程式: 。
21.(6分)食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成一种无机含氮化合物,反应式为:2-NH2+H2SO4+2H+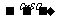 某无机含氮化合物
某无机含氮化合物
Ⅱ.该无机化合物在凯氏定氮器中与碱作用,通过蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅰ步生成的无机含氮化合物化学式为: 。
(2)乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。不法分子通过在低蛋白含量的奶粉中加入三聚氰胺(Melamine)来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。三聚氰胺的化学式为C3H6N6, 假定奶粉中蛋白质含量为16%即为合格,不法分子用蛋白质含量为0的假奶粉制一罐总质量为500g的“达标”奶粉,只需要掺入 g的三聚氰胺。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com