
4.某有机物结构简式为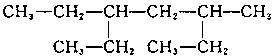 。下列说法不正确的是
。下列说法不正确的是
A.该有机物属于饱和烷烃
B.该烃的名称是3-甲基-5-乙基庚烷
C.该烃与2,5-二甲基-3-乙基己烷互为同系物
D.该烃的一氯取代产物共有8种
3.用NA表示阿伏伽德罗常数,下列说法正确的是 ( )
( )
A.在0℃,101kPa,1molSO3中含有NA个硫原子
B.1molC8H18分子中含有的共用电子对数为26NA
C.0.5L0.1mol/LNH4Cl溶液中含NH4+离子的数目为0.05NA
D.反应KClO3 + 6HCl == KCl + 3Cl2↑+ 3H2O中,每生成1molCl2转移的电子为2NA
2.下列物质分子中,既含有极性键又含有非极性键的非极性分子是 ( )
( )
A.C2H4 B.Br2 C.Na2O2 D.H2O2
1.下列有关判断的依据不正确的是 ( )
( )
A.氧化还原反应:是否有元素化合价的变化
B.苯的同系物:分子中只含有苯环和烃基
C.化学平衡状态:平衡体系中各组分的质量分数不再改变
D.离子化合物:是否含有离子键
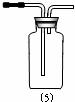
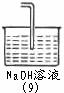
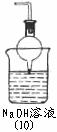
(五)尾气吸收装置能否用(9): (填“能”或“否”)(1分);
理由是 .(2分)
29.(共16分)已知:(CH3)2C=CHCH3 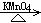 (CH3)2C=O+CH3CHO
(CH3)2C=O+CH3CHO
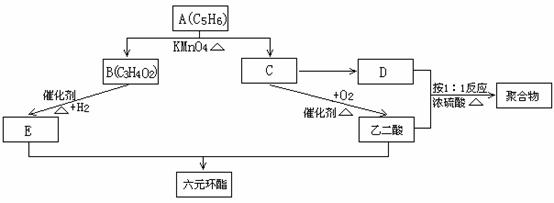
(1)写出A的结构简式: ;(2分)B的结构简式: ;(2分)C的名称: ;(2分)
(2)C至D的反应类型为 ;(2分)
根据D的物理特性写出它的一种用途: ;(2分)
(3)写出E与乙二酸反应生成六元环酯的化学反应方程式:
;(3分)
(4)写出D与乙二酸按1:1反应生成聚合物的化学反应方程式:
;(3分)
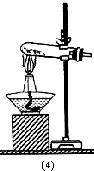
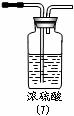
(四)收集二氧化硫气体时能否用(6): (填“能”或“否”)(1分);
理由是 .(2分)
(三)实验室制取二氧化硫气体的离子反应方程式为:
.(3分)
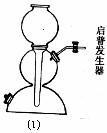
(二)能否选用(1)做为二氧化硫气体发生装置: (填“能”或“否”)(1分);
理由是 .(2分)
(一)气体发生器置于左侧,气体向右方流动,所用仪器依次连接序号为
.(2分)
6.北京奥运会“水立方”游泳池中的水主要是通过砂滤、臭氧、活性炭来净化的,下列有关说法不正确的是 ( )
A.砂滤是利用过滤原理除去水中较大的固体颗粒
B.用臭氧杀菌消毒是因为臭氧具有强氧化性
C.游泳池中的臭氧浓度越高越好
D.活性炭可以吸附水中悬浮的杂质
7.“进行化学实验,观察实验现象,通过分析推理得出正确的结论”是化学学习方法之一.下列对有关实验事实的解释正确的是 ( )
A.溴水中通入SO2后,溶液颜色褪去,说明SO2具有漂白性
B.燃着的镁条在二氧化碳气体中剧烈燃烧,生成白色粉末和黑色固体,说明镁燃烧时不能用二氧化碳灭火
C.向鸡蛋白溶液中加入饱和(NH4)2SO4溶液,出现白色沉淀,说明鸡蛋白发生了变性
D.氢气在氯气中安静燃烧,发生苍白色火焰,说明氢气与氯气作用直接生成了挥发性的盐酸
8.下列离子方程式中,只能表示一个化学反应的是 ( )
①CO32-+2H+==CO2↑+H2O
②Ba2++2OH-+2H++SO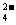 ==BaSO4
==BaSO4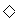 +2H2O
+2H2O
③Cl-+Ag+==AgCl↓
④Fe + Cu2+ == Fe2+ + Cu
⑤Cl2+H2O=H++Cl-+HClO
A.①③ B.②④ C.②⑤ D.只有⑤
9.下图是制取和收集某气体的实验装置(必要时可以加热),该装置不适用于 ( )
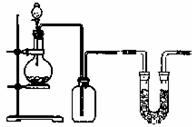
A.用浓硫酸和亚硫酸钠制取二氧化硫
B.用浓硝酸和铜反应制取二氧化氮
C.用稀硝酸和铜反应制取一氧化氮
D.用石灰石和稀盐酸反应制取二氧化碳
10.夏日的夜晚,可常看到儿童手持发光的“魔棒”在广场上嬉戏.“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发生荧光,草酸二酯(CPPO)的结构简式如下图,下列有关说法正确的是 ( )
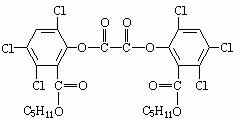
A.草酸二酯的分子式为C26H24Cl6O8
B.1mol草酸二酯与NaOH稀溶液反应,最多消耗8molNaOH
C.草酸二酯水解可以得到两种有机产物
D.1mol草酸二酯与H2完全反应,需要H28mol
11.下列分类正确的是 ( )
A.草酸、碱式碳酸铜、小苏打分别属于酸、碱、盐
B.水、明矾、碱石灰分别属于纯净物、化合物、混合物
C.铜、酒精、冰醋酸分别属于电解质、非电解质、弱电解质
D.钠、铝、铁工业常用的制备方法分别是电解法、热还原法、热分解法
12.设NA为阿伏加德罗常数,下列说法正确的是 ( )
A.标准状况下,22.4LNO2和N2O4的混合气体分子数为NA
B.1mol-CH3和1molOH-都含有10NA个电子
C.250mL1mol/L的CuCl2溶液中Cu2+总数为0.25NA
D.1molNa2O和1molNa2O2晶体中离子总数分别是3NA和4NA
13.叠氮酸(HN3)与醋酸酸性相似,下列叙述中正确的是 ( )
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)> c(N3-) > c(H+)> c(OH‑)
B.HN3与NH3作用生成的叠氮酸铵是共价化合物
C.NaN3水溶液中离子浓度大小顺序为:c(Na+)> c(N3-)> c(H+)> c(OH-)
D.N3-与CO2含相同电子数
非选择题(非选择题共10题,共174分)
26.(14分)X、Y、Z、W为原子序数依次增大的四种短周期元素.它们的电子层数之和为10,Y、W为同族元素,Y的单质为气体,W的单质为淡黄色固体;X原子的最外层电子数是其原子层数的二倍也是其内层电子数的二倍;Z原子最外层电子数与最内层电子数相等,其单质在XY2气体中可以燃烧生成一种黑色一种白色两种产物.
(1)写出元素符号:X_________,Z_________;(各2分)
(2)写出化合物CaX2中,由X形成的双核阴离子的电子式:_________;(2分)
(3)写出X与W形成的化合物的结构式:______________;(2分)
(4)写出Z单质在XY2气体中燃烧的化学反应方程式______________________;(3分)
(5)若17g H2W完全燃烧放出Q kJ热量(Q>0),则H2W完全燃烧的热化学方程式为(用化学式表示):_____________________________________________.(3分)
27.(共16分,第①小题每空2分,其余每空3分)
已知:A为淡黄色固体,E、F、G为单质,且E、F、H为无色气体,I为红棕色气体,J与盐酸反应生成不溶于X的白色沉淀.
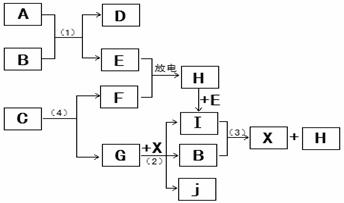
①的焰色反应为黄色,则D的电子式为:___________;
F的电子式为:__________;
②写出反应(1)的离子反应方程式:__________________________;
写出反应(3)的离子反应方程式:__________________________;
|
④ 1molC通过反应(4)得到1molG,C中G的质量分数为72%,则C的化学式为:
__________;
28.(共14分)实验室常用亚硫酸钠(粉末)与80%的浓硫酸反应来制取二氧化硫气体,请从下列仪器中选择装配适当的实验装置以制取、收集干燥的二氧化硫气体,并收集尾气:



湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com