
4.下列实验或叙述不符合绿色化学理念的是 ( )
A.研制乙醇汽油代替汽油作汽车燃料
B.采用银作催化剂,乙烯和氧气制取环氧乙烷(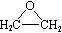 )
)
C.在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水
D.用铜和稀HNO3反应制取Cu(NO3)2
3.下列关于有机物的说法中,不正确的是 ( )
A.液化石油气和天然气的主要成分都是甲烷
B.苯、乙醇和乙酸都能发生取代反应
C.油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂
D.用新制的Cu(OH)2可检验尿液中的葡萄糖
2.从化学角度分析,下列叙述不正确的是 ( )
A.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
B.凡含有食品添加剂的食物都不利于人体健康
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
D.碳酸钠俗称纯碱,与它的水溶液呈碱性有关
1.金属钛对人体无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关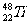 和
和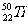 的说法中正确的是 ( )
的说法中正确的是 ( )
A.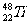 和
和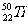 原子中均含有22个中子
原子中均含有22个中子
B.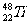 和
和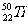 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.分别由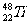 和
和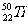 组成的金属钛单质物理性质相同
组成的金属钛单质物理性质相同
D.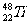 和
和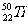 为同一核素
为同一核素
21.(10分)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,反应均生成Cu2+、Mn2+、SO2和H2O,其中Cu2S与酸性KMnO4溶液反应的离子方程式为:
8MnO4-- + 5Cu2S + 44H+ == 10Cu2+ + 5SO2 + 8Mn2+ + 22H2O
反应后煮沸溶液,赶尽SO2,取出剩余溶液的十分之一用0.1mol/L(NH4)2Fe(SO4)2溶液滴定,终点时恰好用去35.00mL (NH4)2Fe(SO4)2溶液,反应的离子方程式为:
MnO4-- + 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O
(1)写出该条件下CuS与酸性KMnO4溶液反应的离子方程式: ;在此反应中,若生成22.4LSO2(标准状况),则反应中转移的电子为 mol。
(2)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2•6H2O (M=392g/mol)的质量为 g,配制时所需要的定量仪器是 。
(3)求混合物中CuS的质量分数。
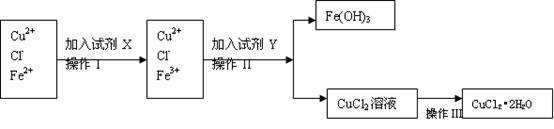
20.(10分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。
 请参照下表给出的数据填空。
请参照下表给出的数据填空。
|
|
氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
Cu2+ Fe2+ Fe3+ |
4.7 7.0 1.9 |
6..7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示); 。
19.(10分)实验室利用足量的NH3在加热的条件下与CuO充分反应生成Cu、N2、H2O,并测定Cu的相对原子质量。装置图如下:
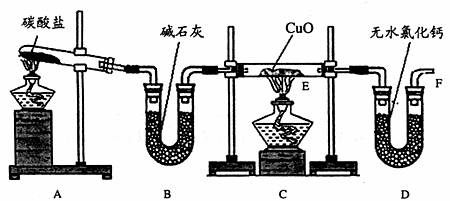
(1)连接好装置后检验装置气密性的方法是 。
(2)用装置A、B制取纯净、干燥的氨气,大试管内碳酸盐的化学式为: ,装置B中碱石灰的作用是: 。
(3)实验中观察到C装置的E管中产生的现象有: ,E管中发生反应的化学方程式为: 。
(4)从实验中测得了下列数据:
①空E管的质量a;
②实验前E管和CuO的总质量b;
③充分反应后E管和Cu粉的总质量c(冷却到室温,干燥后称量);
④充分反应后D管及内盛物质的总质量d
请选择合理的数据列出计算Cu的相对原子质量的计算式(除Cu外,其它涉及到的元素的相对原子质量均为已知);Ar(Cu)== 。
18.(8分)下图表示某典型金属单质A与其化合物之间的转化关系(某些产物和反应条件已略去)。已知:图中所示物质中的组成元素均为短周期元素,化合物C中含有两种金属元素,反应⑤用于工业制取A,反应⑥的产物过滤后得到化合物D的溶液呈碱性。
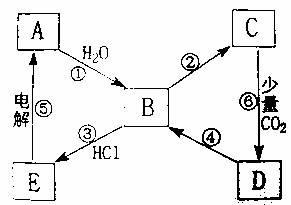
(1)一步实现图中①至⑥的转化关系中一定属于复分解反应的是(填序); 。
(2)写出一步实现反应④所需加入的化学试剂(填化学式); 。
(3)写出反应①的离子反应方程式: 。
(4)B→C的转化有多种途径,试写出其中两种不同反应类型的化学反应方程式:
; 。
16.(8分)请选择“增大”、“减小”、“不变”、“大于”、“小于”或“等于”填空:
(1)升高温度时,水的pH将
。
(2)用水稀释0.1mol/L氨水时,c(OH-)/c(NH3•H2O)的比值将
。
(3)pH相同的盐酸和醋酸,分别用蒸馏水将其稀释到原来的m倍和n倍,稀释后两溶液的pH仍相同,则m n。
(4)将标准状况下的2.24L CO2通入150mL 1mol/L NaOH溶液中,则 c(HCO3-) c(CO32-)。17.(9分)A、B、M、X、Y、Z是周期表中的前20号元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
c(HCO3-) c(CO32-)。17.(9分)A、B、M、X、Y、Z是周期表中的前20号元素,且原子序数依次增大。已知它们的部分化合物的性质如下:
|
A的最简氢化物 |
B的最简氢化物 |
M的最简氢化物 |
X的氧化物 |
Y的最简氢化物分子构型 |
Z的最高价氧化物 |
|
含氢量最高的有机物 |
水溶液呈碱性 |
水溶液呈酸性 |
两性氧化物 |
正四面体 |
对应的水化物为最强酸 |
回答下列问题:
(1)B的最简氢化物的分子构型是:
。
(2)M、X、Z三种元素的简单例子的离子半径由小到大的顺序是(用离子符号和“>”表示)
。
(3)已知M的单质与NaOH溶液反应的产物之一是OM2,试写出该反应的化学方程式:
。
(4)写出B的最简氢化物与Z的氢化物反应后生成物的电子式 。
(5)试比较A和Y的最高价氧化物熔点的高低(用“>”、“ <”或“=”表示);
,并说明理由
。
(6)A元素形成的氢化物有多种,1molA的某种氢化物分子中含有14mole-。已知在25℃,101kPa时1g该氢化物在足量氧气中充分燃烧生成液态水时放出的热量为50kJ,请写出该反应的热化学方程式:
。
15.在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的离子浓度为0.2mol/L,当加入等体积0.2mol/LKOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+离子的浓度最接近于 ( )
( )
A.0.125mol•L-1 B.0.225mol•L-1 C.0.250mol•L-1 D.0.450mol•L-1
第II卷(非选择题 共55分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com