
18.(2分)一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。
某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某位置浓度的NaOH溶液。下列有关说法中正确的是
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.若选用100mL容量瓶配制标准酸溶液,需用密度为1.84g/cm3、98%的浓硫酸5.4mL;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓 度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.若配制标准酸溶液在定容时俯视读数,则导致所测的NaOH溶液浓度偏大;
G.中和滴定实验,若在滴定前平视读数,滴定结束俯视读数,则导致实验结果偏大。
17.取xg铜镁合金溶于浓硝酸中,反应过程中硝酸被还原产生8960mL的NO2气体和672ml的N2O4气体(都已折算到标准状态),在反应后的溶液中加足量的氢氧化钠溶液,生成沉淀质量为17.02g。下列判断不正确的是 ( )
A.参加反应的硝酸是0.92mol
B.合金中镁的质量5.9g
C.反应过程中转移的电子数为0.46mol
D.合金中含有铜0.092mol
主观题Ⅱ(非选择题,共58分)
16.X、Y、Z、W为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y最外层电子数多3,W是短周期中原子半径最小的元素。下列叙述正确的是 ( )
A.X与W形成的化合物中只含有极性键
B.Z单质与X单质直接反应可生成两种化合物
C.X和Y形成的化合物既能与酸反应又能与碱反应
D.原子半径的大小顺序:X>Y>Z
15.为达到预期的实验目的,下列操作正确的是( )
① 配制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
② 用10ml的量筒量取4.80ml的浓硫酸
③ 蒸发溶液时,边加热边搅拌,直至蒸发皿中的液体蒸干
④ 向无色溶液加BaCl2溶液生成白色沉淀,再加稀硝酸,沉淀不消失,由此确定该溶液中一定含有SO42-
⑤ 为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
⑥ 中和热测定的实验中使用的玻璃仪器只有2种
⑦ 实验室可利用浓氨气和碱石灰混合的方法制取少量氨气
⑧ 除NO中混有的NO2气体可通过水洗,再干燥后向上排空气法收集
A.③⑤⑧ B.④⑤⑥ C.①⑤⑦ D.①⑦⑧
14.某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是 ( )
① 肯定不含I-; ② 肯定不含Cu2+; ③ 肯定含有SO32-;
④ 可能含有I-; ⑤ 可能含有SO32-;
A.①②③ B.②④⑤ C.①②⑤ D.②③④
13.将一定量的钠铝合金置于水中,合金全部溶解,得到2mlPH=14的溶液,然后用1mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是 ( )
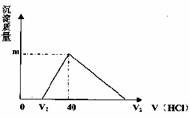
A.原合金质量为0.92g B.标准状态下产生氢气896ml
C.图中m值为1.56g D.图中V2为60ml
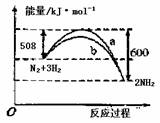
12.N2与H2反应过程中能量变化曲线如图所示。若在一个固定容积的密闭容器中充入1molN2和3molH2使反应N2+3H2  2NH3达到平衡测得反应放出热量为Q1。下列叙述正确的是
( )
2NH3达到平衡测得反应放出热量为Q1。下列叙述正确的是
( )
A.该反应的热化学方程式为:
N2(g)+3H2(g)
 2NH3(g)
△H=-Q1kJ·mol-1
2NH3(g)
△H=-Q1kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.上述条件下达平衡时H2的转化率为3Q1/92
D.在温度体积一定的条件下,若通入2molN2和6molH2反应后放出的热量为Q2kJ,则
184>Q2>2Q1
11.常温下,0.1mol·L-1某一元酸(HA)溶液中c(OH-)/ c(H+)=1×10-8,下列叙述正确的是 ( )
A.该溶液中由水电离出的c(H+)=1×10-3 mol·L-1
B.由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中
c(Na+)>c(A-)>c(OH-)>c(H+)
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,
则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-)
D.0.1 mol·L-1HA溶液与0.05 mol·L-1NaOH溶液等体积混合后
溶液中2 c(H+)+ c(HA)= c(A-)+2 c(OH-)
10.混合下列各组物质使之充分反应,加热蒸干产物并在300℃灼烧至质量不变,最终残留固体不是纯净物的是 ( )
A.向Fe、FeO和Fe2O3的混合物中加入过量的盐酸
B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液
C.等物质的量的NaHCO3溶液与Na2O2固体
D.在NaBr溶液中通入过量氯气
9.下列说法不正确的是 ( )
① △H<0,△S>0的化学反应一定能自发进行
② 若R2-和M+的电子层结构相同,则原子序数:R>M
③ F2、Cl2、Br2、I2熔点随相对分子质量增大而升高
④ NCl3、PCl3、CO2、CS2分子中各原子均达到8e-电子稳定结构
⑤ 若X的质子数为a,中子数为b,则原子可表示为abX
⑥ 原电池在工作时电子由负极通过溶液流向正极
⑦ 由于氨和水分子之间能形成氢键,NH3分子极易溶于水
⑧ 原子序数为34号的元素属于长周期的副族元素
A.②⑤⑥⑧ B.①③④⑤ C.②④⑤⑦ D.③⑤⑦⑧
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com