
29.(17分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ·mol-1
H2O(l)=H2O(g) △H=+44kJ·mol-1
则356g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为 。
(2)熔融盐燃料电池具有很高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气体为正极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:正极反应式:
O2+2CO2+4e-=2CO2-3,负极反应式 。
(3)已知一氧化碳与水蒸气的反应为:
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
①T℃时,在一定体积的容器中,通入一定量的CO(g)和H2O(g),发生反应并保持温度不变,各物质浓度随时间变化如下表:
T℃时物质的浓度(mol/L)变化
|
时间/min |
CO(g) |
H2O(g) |
CO2(g) |
H2(g) |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
0.100 |
0.200 |
0.100 |
0.100 |
|
4 |
0.100 |
0.200 |
0.100 |
0.100 |
|
5 |
0.116 |
0.216 |
0.084 |
c1 |
|
6 |
0.096 |
0.266 |
0.104 |
c2 |
第5、6min时的数据是保持温度和体积不变时,改变某一条件后测得的。第4~5min之间,改变的条件是 。T℃时该化学反应的平衡常数是 。
②已知420℃时,该化学反应的平衡常数为9,如果反应开始时,CO(g)和H2O(g)的浓度都是0.01mol/L,则CO在此条件下的转化率为 。
③397℃时,该反应的化学平衡常数为12,请判断该反应的△H 0(填“>、=、<”)。
(4)燃料电池中产生的CO2气体可以用碱液吸水得到Na2CO3和NaHCO3。常温下向20mL0.1mol/LNa2CO3溶液中逐滴加入0.1mol/HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如下图所示。根据图象回答下列问题:
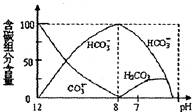
①在同一溶液中,H2CO3、HCO-3、CO2-3(填:“能”或“不能”) 大量共存。②当pH=7时溶液中含碳元素的主要微粒为 ,此时溶液中c(HCO-3) c(Na+)(填“>、=、<”)。
28.(14分)I.通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌等金属和少量矿物杂质(与酸不反应)。制作电器及其他仪器产品时必须要求是纯铜,为此以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯。
表:几种物质形成沉淀时的pH
|
物质 |
Fe(OH)2 |
Fe(OH)3 |
Zn(OH)2 |
Cu(OH)2 |
|
开始沉淀时的pH |
7.6 |
2.7 |
5.7 |
4.7 |
|
完全沉淀时的pH |
9.7 |
3.7 |
8.5 |
7.3 |
(1)在精炼铜时,阴极电极反应方程式为 ;金、银以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底。
(2)在精炼铜的过程中,Cu2+浓度逐渐降低,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了如下除杂流程:

|
a.氯水 b.高锰酸钾溶液 c.硝酸 d.双氧水
②操作①是 ,根据上表数据分析,除杂方案中能够除去的杂质金属阳离子是 (填化学式)。
II.重金属离子对河流海洋等会造成严重的污染。某化工厂产生的废水(pH=2.0,密度为1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度约为0.01mol·L-1,排放前拟用沉淀法回收这两种金属,查找有关数据如下:
|
难溶电解质 |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
|
Ksp |
8.3×10-17 |
5.6×10-8 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投入 (填字母序号)沉淀的效果最好。
a.NaOH b.Na2S c.KI d.Ca(OH)2
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
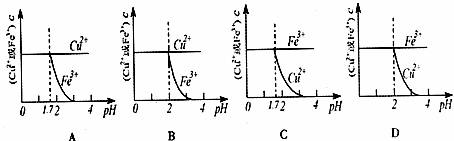
15.已知的KSP[Cu(OH)2]=2.2×10-20、KSP[Fe(OH)3]=4.0×10-38,Cu2+和Fe3+完全以氢氧化物沉淀时的pH分别为:6.7和3.2。现在向pH=0、浓度均为0.04mol·L-1的Cu2+、Fe3+溶液中加入某一固体,以中和H+调节pH(设溶液体积不变),该过程中Cu2+、Fe3+的浓度与pH关系正确的是 ( )
第Ⅱ卷(必做+选做)
[必做部分]
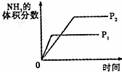
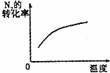
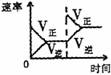
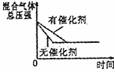
14.对于可逆反应N2(g)+3H2(g) 2NH3(g);△H<0,下列的选项和图示相符的是 ( )
2NH3(g);△H<0,下列的选项和图示相符的是 ( )
|
|
A |
B |
C |
D |
|
研究 目的 |
压强对反应的影响 |
温度对反应的影响 |
平衡体系增加N2对应的影响 |
催化剂对反应的影响 |
|
图示 |
 |
 |
 |
 |
13.根据下列实验现象,所得结论不正确的是 ( )
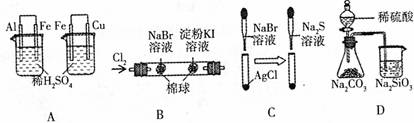
|
实验 |
实验现象 |
结论 |
|
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 |
金属活动性: Al>Fe>Cu |
|
B |
左边棉花先变橙色后颜色逐渐变浅,右边棉花先变蓝色后变无色 |
单质氧化性: Cl2>Br2>I2 |
|
C |
白色固体先变为淡黄色,后变为黑色 |
溶度积Ksp AgCl>AgBr>Ag2S |
|
D |
锥形瓶中有气体产生,烧杯中有液体有浑浊现象 |
元素非金属性: S>C>Si |
12.如图为一种钮扣微型电池,其电极分别为Ag2O和Zn,电解质溶液中KOH溶液,俗称银锌电池,该电池的总反应式为:Zn+Ag2O===ZnO+2Ag;根据以上提供的资料,判断下列说法正确的是 ( )
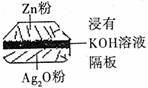
A.负极反应为Zn-2e-===Zn2+
B.放电时正极附近溶液的pH升高
C.放电时负极附近溶液的pH升高
D.溶液中阴离子向正极方向移动,阳离子向负极方向移动
11.下列表述正确的是 ( )
A.0.1mol·L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
C.浓度均为0.1mol·L-1的CH3COONa、NaOH和Na2CO3三种溶液的pH大小顺序:
pH(NaOH)>pH(Na2CO3)>pH(CH3COONa)
D.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至中性,溶液中离子浓度的关系:
c(CH3COO-)>c(Na+)>c(OH-)=c(H+)
10.每个公民都应该有安全意识,今年频繁发生的有关化学中泄漏或爆炸事件一次又一次给我们敲响了警钟。下列做法存在安全隐患的是 ( )
①将水沿着烧杯内壁缓缓加入浓硫酸中,并用玻璃棒不断搅拌
②给试管中液体加热时,应将试管,与桌面成45°角,先均匀受热再集中在药品处加热
③取用金属Na或K时,用剩的药品要放回原瓶
④夜间厨房发生煤气泄漏时,应立即开灯检查煤气泄漏原因,并打开所有门窗通风
A.全部 B.①②④ C.①③ D.①④
9.化学与生活、社会密切相关。下列各组说法中都不正确的是 ( )
①利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境
②为防止电池中的重金属等污染土壤和水体,应积极开发、生产无汞电池和废电池的综合利用技术
③凡含有食品添加剂的食物对人体健康均有害,不可食用
④为减少大气污染,用天然气代替汽油和柴油作为发动机燃料,鼓励私人购买和使用汽车代替公交车
⑤提倡人们不用塑料袋或一次性发泡塑料餐具
⑥为减少生活污水对水体污染,积极开发、使用无磷洗涤剂
A.①④⑤⑥ B.②③④ C.①②④⑤ D.③④
33.[化学--有机化学基础]化合物A是一种食用香料,分子式为C11H12O3,其合成路线如下:
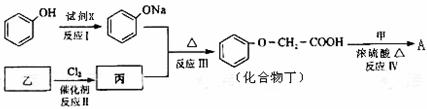
已知:
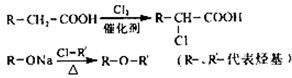
试回答:
(1)若反应原理考虑,试剂X不可以选用的是(填字母) 。
a.NaOH溶液 b.Na2CO3溶液 c.NaHCO3溶液 d.Na
(2)丙的结构简式是 ,反应II的反应类型苯环上是 。
(3)化合物丁有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有两种一硝基取代物的同分异构体是(写出任意2种) 。
(4)已知化合物甲为链状结构,分子结构中不含甲基。试写出反应IV的化学方程式。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com