
4.25℃时,水的电离达到平衡:H2O H++OH-;ΔH>0,下列叙述正确的是 ( )
H++OH-;ΔH>0,下列叙述正确的是 ( )
A.将水加热,KW增大,溶液的pH增大
B.向水中加入稀氨水,平衡正向移动,c(OH-)增加
C.向水中加入少量固体硫酸氢钠,c(H+)降低,KW不变
D.向水中加入少量固体CH3COONa,平衡正向移动,c(OH-)增加
3.下列说法不正确的是 ( )
A.用饱和Na2CO3溶液除去乙酸乙酯中混有的乙酸和乙醇
B.电解精炼铜时,相同时间内阳极溶解铜的质量比阴极析出铜的质量小
C.将溴乙烷与NaOH溶液共热后冷却,再滴加硝酸银溶液检验水解产物中的溴离子
D.硫酸工业中,在接触室安装热交换器是为预热反应气体,达到适宜的反应温度
2.2008年8月8日第29届奥运会在北京举行。下列说法正确的是 ( )
A.奥运会场馆“鸟巢”使用的Q460特殊钢属于合金
B.奥运会期间使用的大型遥控飞艇充入的安全且轻的气体是氢气
C.奥运会场馆“水立方”用的新研制涂料氮化镓属于硅酸盐材料
D.奥运吉祥物“福娃”制品内的填充物聚酯纤维是天然高分子材料
1.下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是 ( )
A.盐酸、天然气、醋酸、干冰
B.胆矾、漂白粉、氯化钾、氯气
C.氯化钠、福尔马林、硫酸钠、乙醇
D.单甘油酯、混甘油酯、苛性钾、石灰石
24.(18分)某同学欲在实验室中完成Fe与水蒸气反应的实验,装置如图所示甲、乙两种。
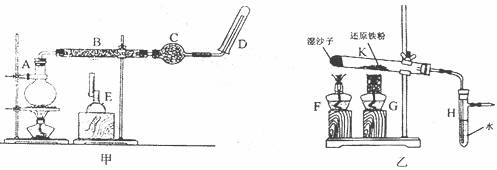
已知B中放入的是铁与石棉绒的混合物,C中放的是干燥剂,E为酒精喷灯,G为带有铁丝网罩的酒精灯。
Ⅰ对比两装置,回答下列问题:
(1)如何检查乙装置的气密性? 。
(2)乙装置中湿沙子的作用是 。
(3)B处发生反应的化学方程式: 。
(4)该同学认为欲在乙装置的尖嘴导管处点燃反应产生的气体,装置H必不可少,H的作用是 。
(5)对比甲、乙两装置的B和K,B的优点是 。
Ⅱ某同学为了研究一定时间内铁粉的转化率,用上图中的甲装置设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算铁粉的转化率。
① 用排水法收集并测量气体体积可选下图中的 装置。
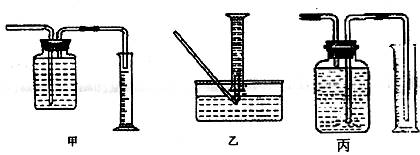
② 称取mg铁粉与适量石棉绒混合,然后加热至无气体放出。若收集的气体体积换算为标准状况为VL,铁粉的转化率为(列出计算式即可) 。
③ 为了证明反应后的固体混合物中含有+3价的Fe,该同学取出少量混合物于试管中,加入足量的盐酸,溶解后过滤,立即向溶液中滴加KSCN溶液,结果观察到溶液的颜色没变化。经过思考,该同学认为此现象不能说明反应后的固体混合物中不含有+3价Fe。他的理由是: 。
23.(7分)下列转化关系中,A~L均是中学化学中常见的物质。A为金属单质;D为非金属单质;B在常温常压下为无色液体;G为不溶于水但可溶于铵盐的白色固体;I为无色气体;D与E的浓溶液在加热时发生⑥反应。
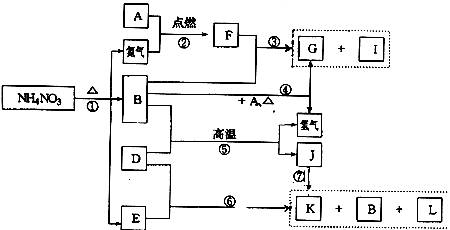
请回答:
(1)F物质的化学式为 ;J物质的化学式为 ;
I物质的结构简式为 ;
(2)写出I催化氧化的化学方程式: ;
(3)写出⑥的化学方程式: 。
22.(10分)A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)化合物M中含有的化学键类型有 ;
(2)比较B、C、E形成的气态氢化物的稳定性: > > (用化学式表示)
(3)写出C与E两元素形成的化合物与Y溶液反应的离子方程式: ;
(4)以铂作电极,以Y溶液作为电解质溶液,A、C元素的单质分别在两电极上发生原 电池反应,则负极上的电极反应式为 ;常温下若以该电池作为电源,用惰性电极电解1L1mol·L-1的NaCl溶液,当溶液的pH=3时,(溶液体积变化忽略不计)理论上消耗元素A的单质在标准状况下的体积为 。
21.(18分)化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ.(8分)有甲、乙两个容积相等的恒容密闭容器,
发生反应3A(g)+B(g)
 xC(g) △H=QKJ/mol
xC(g) △H=QKJ/mol
回答下列问题
(1)下列各项能作为判断该反应达到化学平衡状态的依据是 (填序号)
① v(A)=3v(B) ② 混合气体的密度保持不变
③ 有3molA消耗的同时有1molB生成 ④ C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q 0(填 “大于”或“小于”)
(3)向甲中通入6molA和2molB,向乙中通入1.5molA、0.5molB和3molC,将两容器 的温度恒定在770K,使反应3A(g)+B(g)
 xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数为0.2。
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数为0.2。
① 若平衡时,甲、乙两容器中A的物质的量相等,则x= ;
若平衡时,甲、乙两容器中A的物质的量不相等,则x= 。
② 平衡时甲中A的体积分数为 ;
③ 若平衡时两容器的压强不相等,则两容器中压强之比为 。
Ⅱ.(5分)
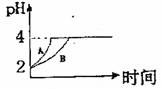
(1)室温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒, 反应过程中两溶液的pH变化如下图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”)设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2
(选填“<”、“=”、“>”)。
(2)若室温下pH=2的盐酸和醋酸溶液各100mL,分别加水稀释后使pH=4,设盐酸中 加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则:V1 V2(选填“<”、“=”、“>”)。
Ⅲ.(2分)已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2(氯化 亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是 。
Ⅳ.(3分)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常 数Ksp=cm(An+)×cn(Bm-),称为难溶电解质的溶度积。
① 在25℃,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是 ;
② 下列叙述不正确的是 (填字母)
A.溶度积小的沉淀可以转化为溶度积更小的沉淀
B.25℃时,AgCl固体在等物质的量浓度NaCl、CaCl2溶液中的溶度积相同。
C.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
20.(4分)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ·mol-1
② CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
(1)根据上述信息,写出CH4与NO2生成N2和水蒸气的热化学方程式: ;
(2)若用标准状况下44.8mlCH4还原112mlNOx至N2,则NOx中NO与NO2体积比 。
19.(5分)已知反应:① 2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
② Fe2(SO4) 3+2HI=2FeSO4+I2+H2SO4
③ [ ]K2Cr2O7+[ ]FeSO4+[ ]H2SO4=[ ] Fe2(SO4) 3+[ ] Cr2(SO4) 3+[ ] K2SO4+[ ] H2O
(1)上述三个反应中,属于氧化还原反应的是 (填序号);
(2)完成并配平反应③的化学方程式,标出电子转移的方向和数目;
(3)K2Cr2O7、I2、Fe3+三种微粒氧化性由强到弱的顺序: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com