
10.将一定体积的某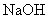 溶液分成两等份。一份用
溶液分成两等份。一份用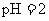 的一元酸
的一元酸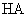 溶液中和,消耗酸溶液的体积为
溶液中和,消耗酸溶液的体积为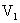 ;另一份用
;另一份用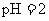 的一元酸
的一元酸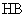 溶液中和,消耗酸溶液体积为
溶液中和,消耗酸溶液体积为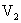 ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A.若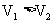 ,则说明
,则说明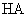 的酸性比
的酸性比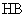 的酸性弱
的酸性弱
B.若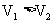 ,则说明
,则说明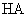 的酸性比
的酸性比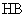 的酸性强
的酸性强
C.因为两种酸溶液的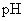 相等,故
相等,故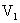 一定等于
一定等于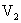
D.若将两种酸溶液等体积混合,混合溶液的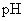 一定等于2
一定等于2
9.将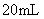
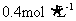 硝酸铵溶液与
硝酸铵溶液与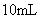
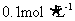 氢氧化钡溶液混合,则混合后溶液中各离子浓度的大小顺序是( )
氢氧化钡溶液混合,则混合后溶液中各离子浓度的大小顺序是( )
A.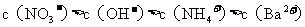
B.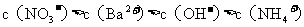
C.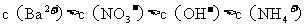
D.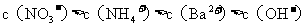
8.已知反应:①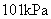 时,
时,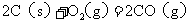 ;
;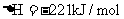 ②稀溶液中,
②稀溶液中,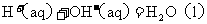 ;
;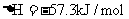
下列结论正确的是( )
A.碳的燃烧热大于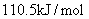
B.①的反应热为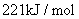
C.稀硫酸与稀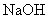 溶液反应的中和热为
溶液反应的中和热为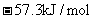
D.稀醋酸与稀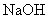 溶液反应生成
溶液反应生成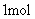 水,放出
水,放出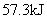 热量
热量
7.下列说法正确的是( )
A.I A族元素的金属性比ⅡA族元素的金属性强
B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强
D.同周期元素的离子半径从左到右逐渐减小
6.甲、乙为短周期不同主族元素组成的单质,丙、丁为氧化物。它们存在如下转化关系: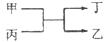 。组成单质甲、乙的元素分别为( )
。组成单质甲、乙的元素分别为( )
A.铝和铁 B.氟和氧 C.碳和氢 D.碳和硅
25.(10分)(1)下表是在1.013×105Pa下测得的几种物质的沸点:
|
结构简式 |
沸点/℃ |
结构简式 |
沸点/℃ |
|
CH3CH3 |
-88.6 |
CH2=CH2 |
-103.7 |
|
CH3CH2CH3 |
-42.2 |
CH2-CH-CH3 |
-47.4 |
|
CH3CH2CH2CH3 |
-0.5 |
CH3CH2CH-CH2 |
-6.3 |
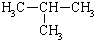 |
-11.7 |
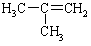 |
-6.9 |
|
CH3CH2CH2CH2CH3 |
36.1 |
CH3CH2CH2CH=CH2 |
30 |
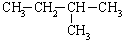 |
|
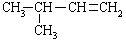 |
20.1 |
从表中数据分析,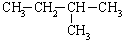 在1.013×105Pa、25℃时的状态是 (填气态、液态或固态)。
在1.013×105Pa、25℃时的状态是 (填气态、液态或固态)。
(2)石油裂解是一个复杂的过程,其产物为混合物。例如:
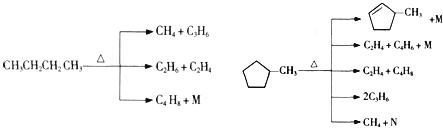
①上述烷烃和环烷烃裂解反应中,产物M的化学式为 ,N的化学式为 。
24.(13分)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示:
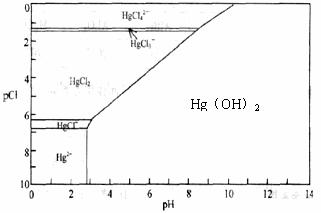
(注:粒子浓度很小时常用负对数表示,如pH=-lgc(OH-),pCl=-lgc(Cl-)):
请根据上图回答问题:
(1)正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是 。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为 。
②化学沉淀法:用硫化钠处理含HgCl2的废水,生成HgS沉淀。反应的离子方程式为 。
(4)汞虽然有毒,但用途广泛。用汞和溴化钙作催化剂,可以在较低温度下经过下列反应使水分解制氢气和氧气:
①CaBr2+2H2O=Ca(OH)2+2HBr↑
|
③HgBr2+Ca(OH)2=CaBr2+HgO+H2O
④2HgO 2Hg+O2↑
2Hg+O2↑
反应②的化学方程式为 。
23.(11分)从含镍废催化剂中可回收镍,其流程如下:
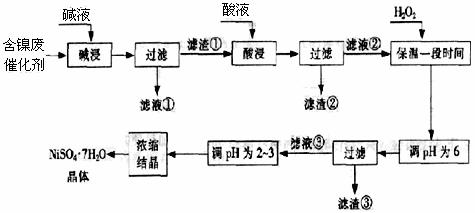
某油脂化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。部分阳离子以氢氧化物形式完全沉淀时溶液pH如下:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
9.2 |
回答下列问题:
(1)“碱浸”的目的是除去 。
(2)“酸浸”时所加入的酸是 (填化学式)。酸浸后,滤液②中可能含有的金属离子是 。
(3)“调pH为2~3”的目的是 。
(4)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),可能是由于生产过程中
导致Fe2+未被完全氧化造成的。
(5)NiSO4在强碱溶液中用NaClO氧化,可制得碱性镍镉电池电极材料--NiOOH。该反应的离子方程式是 。
22.(10分)下表是元素周期表主族元素的一部分。
|
W |
X |
Y |
|
|
|
Z |
短周期元素X的最高正价是+5价,Y单质可在空气中燃烧。
(1)Z的元素符号是 ,原子结构示意图是 。
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为 。
(3)探寻同一主族元素性质的一些共同规律,是学习化学的重要方法之一。在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式。
|
编号 |
性质推测 |
化学方程式 |
|
示例 |
氧化性 |
H2ZO3+4HI=Z↓+2I2+3H2O |
|
1 |
|
|
|
2 |
|
|
(3)请设计实验方案进一步确定该固体混合物的组成。叙述实验操作、预期现象和结论。
[提示]①按以下方式作答,注意前后内容对应;
②注意文字简洁,可以不填满。
|
实验操作 |
预期现象和结论 |
|
|
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com