
26.(13分)有三种常见短周期元素A、B、C,它们的原子序数依次增大。A元素原子最外层电子数比B元素原子最外层电子数多1个,B元素原子最外层电子数是C元素原子最外层电子数的一半。甲、乙、丙分别是A、B、C元素最高价含氧酸的钠盐。甲、乙溶液pH>7,丙溶液pH<7。丁为无色、无味的气体,戊为淡黄色固体。各物质之间相互反应关系如下(与变化无关的产物已略去):

试回答:
(1)C元素的名称为 ;丁的结构式为 ;戊的电子式为 。
(2)写出反应①的离子方程式: 。
(3)写出④的化学方程式: 。
(4)工业上可由B的单质与C的最高价氧化物的水化物M并配合其它无机试剂制备庚,则制备1mol庚最少需要M的物质的量为 。
13.某有机物A是农物生产中的一种中间体,其结构简式如下,关于A的叙述正确的是( )

A.属于芳香烃
B.所有原子均可处于同一平面内
C.一定要件下可发生加成反应和消去反应
D.1molA可以与4molNaOH反应
第Ⅱ卷
本卷共10题,共174分。
12.用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则电解过程中转移电子的物质的量约为 ( )
A.6mol B.7mol C.8mol D.9mol
11.如下图所示,隔板I固定不动,活塞II可自由移动。M、N两个容器中均发生如下反应:A(g)+3B(g)  2C(g);△H<0。若起始时,M、N容积相同。下列说法正确的是( )
2C(g);△H<0。若起始时,M、N容积相同。下列说法正确的是( )
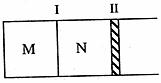
A.起始时,分别向M、N两个容器中加入1molA、1molB,达平衡时,容器M、N中物质A的体积分数相同
B.起始时,分别向M、N两个容器中加入1molA、3molB,达平衡时,容器M中物质A的转化率较大
C.起始时,分别向M、N两个容器中加入2molC,容器N达到平衡所需的时间较短
D.起始时,分别向M、N两个容器中加入1molA、3molB,达到平衡时,容器M中气体的密度较大
10.设NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2L
B.常温下,1L0.1mol·L-1氯化镁溶液中,阳离子总数小于0.1NA
C.常温常压下,56g氮气与一氧化碳的混合气体中所含原子数目为4NA
D.在标准状况下,22.4L的乙烷中含有共价健的数目为0.6NA
9.下列热化学方程式中△H的绝对值表示可燃物燃烧热的是 ( )
A.H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.CO(g)+ O2(g)=CO2(g);△H=-283kJ/mol
O2(g)=CO2(g);△H=-283kJ/mol
8.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.0.1mol·L-1pH=a(a<7)的NaHSO3溶液中:c(HSO-3)>c(H2SO3)>c(SO2-3)
B.10mL 0.5mol·L-1CH3COONa溶液与10mL 1mol·L-1盐酸混合:
c(Cl-)>c(H+)>c(Na+)>c(CH3COO-)>c(OH-)
C.在NaHCO3溶液中一定有:c(Na+)+c(H+)=c(HCO-3)+c(OH-)+c(CO2-3)
D.c(NH+4)相等的(NH4)2SO4溶液、(NH4)2SO4溶液和NH4Cl溶液:
C[(NH4)2CO3]<c[(NH4)2SO4]<c(NH4Cl)
7.下列说法正确的是 ( )
A.氯化钠固体溶于水时离子键受到了破坏
B.氨水能导电,氨气是电解质
C.沸点:HF<HCl<HBr<HI
D.水分子各原子均达到了8电子稳定结构
6.食品安全已成为近几年来社会关注的热点问题之一。下列有关食品添加剂使用的说法正确的是 ( )
A.为了调节食品色泽,改善食品外观,使用工业色素苏丹红
B.为了提高奶粉中的氮的含量,加入适量的三聚腈胺
C.为了防止食品腐败,加入适量苯甲酸钠以达到阻抑制细菌繁殖的作用
D.为了补充食物中缺乏的微量元素碘,在食盐中加入少量的碘单质
10.(14分)煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:

 的平衡常数随温度的变化如下表:
的平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
800 |
|
平衡常数Kc |
9.94 |
9 |
1 |
试回答下列问题:
(1)上述正向反应是: 反应(选填:放热、吸热)
(2)在800℃发生上述反应,以表中的物质的量投入恒容反应器,其中向正反应方向移动的有 (选填A、B、C、D、E)
|
|
A |
B |
C |
D |
E |
 |
3 |
1 |
0 |
1 |
1 |
 |
2 |
1 |
0 |
1 |
2 |
 |
1 |
2 |
3 |
0.5 |
3 |
 |
5 |
2 |
3 |
2 |
1 |
(3)已知在一定温度下:


 平衡常数K
平衡常数K


 平衡常数K1
平衡常数K1


 平衡常数K2
平衡常数K2
则K、K1、K2之间的关系是
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:
(5)若在800℃时进行,设起始时CO和H2O共为5mol,水蒸气的体积分数为x,平衡时CO转化率为y,,则y随x变化的函数关系式为:y=
(6)在VL密闭器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变)。将混合气体燃烧,测得放出的热量为2842kJ(已知燃烧1molCO放热283KJ,燃烧1molH2放热为286KJ.)
则T℃平衡常数K=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com