
1、课本P119-120页:1、2、3、5
1、你知道了二氧化碳的哪些性质,请说出来,并写出有关的化学方程式。
①物理性质:二氧化碳是无色无味的气体,密度比空气大,能溶于水。
②化学性质:二氧化碳不能燃烧,也不支持燃烧;二氧化碳能与水反应生成碳酸;
CO2 + H2O == H2CO3
二氧化碳能与石灰水反应,使澄清石灰水变浓浑浊。CO2 + Ca(OH)2 == CaCO3↓+ H2O
[问题与情景]
在一定条件下,二氧化碳气体可以变成固体,那么固体二氧化碳我们称着什么?它有什么性质?有何用途?
[观察与思考]
①请观察课本P116页图6-17,完成下表。
|
二氧化碳的用途 |
对应的性质 |
|
光合作用 |
|
|
灭火 |
|
|
化工产品的原料 |
|
|
气体肥料 |
|
②从上述表中你可获取什么结论?你还知道二氧化碳的哪些用途,请说出来,并指出它是利用二氧化碳的什么性质?
[归纳与小结]
二氧化碳的用途:
①灭火; ②化工产品的原料; ③干冰作冷剂; ④光合作用; ⑤气体肥料。
[观察与思考]
请观察课本P116页图6-18,回答下列问题:
①什么是“温室效应”?产生“温室效应”的主要气体有哪些?
②地球为什么喊“救命”?
③“人类只有一个地球!”为了保护人类赖以生存的环境,我们应该采取怎样的措施,防止“温室效应”进一步加强?
[问题与情景]
我们知道,碳的氧化物有两种:二氧化碳和一氧化碳。它们都是由碳、氧两种元素组成的,那么它们的性质是否也相同呢?为什么?
回答:①它们的性质应该是相同的,因为它们的组成元素是相同的;
②它们的性质是不同的,虽然它们的组成元素相同,但它们的一个分子中,氧原子的个数不同。
问题:究竟哪种说法是对的呢,下面通过实验来证明。
[活动与探究]
[实验6--7]一氧化碳的燃烧
|
现 象 |
|
|
结 论 |
|
小结:一氧化碳是一种没有颜色、没有气味的气体,它能燃烧,燃烧时放出大量的热,火焰呈蓝色。
2CO + O2 2CO2
2CO2
[问题与情景]
①在煤炉的上方,我们常常看到蓝色火焰出现,请问这是什么气体燃烧的结果?你能写出煤炉中产生该气体的有关化学方程式吗?
小结:一氧化碳气体燃烧
2C +
O2  2CO
2CO
C +
O2 CO2;2C + CO2
CO2;2C + CO2 2CO
2CO
②在冬天用煤(或木炭)取暧或用燃气洗澡时,若室内不通风,容易造一氧化碳中毒。那么为什么一氧化碳能使人中毒呢?
[活动与探究]
[实验6--8]
|
现 象 |
|
|
结 论 |
|
交流:一氧化碳的毒性
[讨论与交流]
课本P118页讨论:煤气厂为什么常在家用煤气(含有一氧化碳)中掺入微量具有难闻气味的气体?如发生煤气泄漏应当怎么办?
[问题与情景]
一氧化碳还有什么化学性质?
[活动与探究]
[实验6--9]
|
现 象 |
|
|
结 论 |
|
小结:一氧化碳具有还原性。
CuO
+ CO
 Cu + CO2
Cu + CO2
问题:①在上述反应中,什么物质是还原剂,什么物质是氧化剂?
②举例说明一氧化碳的还原性的用途。
[反思与小结]
① 比较一氧化碳和二氧化碳的性质。
|
|
二氧化碳(CO2) |
一氧化碳(CO) |
|
物理性质 |
|
|
|
化学性质 |
|
|
|
|
|
|
|
|
|
|
|
用 途 |
|
|
为什么一氧化碳和二氧化碳的化学性质不相同?
②通过本节课的学习你还有哪些收获或启示?
[练习与巩固]
4、请根据你已有的知识和日常生活经验,将大气中二氧化碳气体产生和消耗的途径填入下表。
|
大气中二氧化碳的产生途径 |
大气中二氧化碳的消耗途径 |
|
|
|
第二课时
[复习与巩固]
3、家庭小实验:课本P119页
2、讨论:你还能设计一个实验证明二氧化碳与水发生了化学反应吗?若能,请画出实验装置图,并说明实验原理。
1、课本P120页:4、6、7、8
3、通过二氧化碳有关知识的讨论,学习全面的认识与评价自然界中的物质。培养学生的学习兴趣和合作精神,创新精神。树立关注环境、热爱自然的意识。
[教学重点与难点]二氧化碳和一氧化碳的性质,二氧化碳与石灰水反应,一氧化碳的还原性。
[实验准备]二氧化碳、澄清石灰水、稀醋酸、紫色石蕊溶液、蜡烛、稀盐酸、用紫色石蕊浸泡过的小花、一氧化碳、氧化铜、水。
试管、烧杯、玻璃管、铁架台(带铁夹)、试管夹、质地较软的塑料瓶、铁皮、贮气瓶、导气管、火柴、酒精灯。
[课时安排]两课时
[教学设计]
第一课时
[问题与情景]
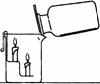 [实验6-4]:如右图装置,向烧杯中倾倒一瓶气体,观察实验现象。
[实验6-4]:如右图装置,向烧杯中倾倒一瓶气体,观察实验现象。
问题:①你观察到什么现象?
②通过实验,你可以得出该气体的哪些性质?
③请你猜一猜,该气体可能是什么气体?设计一个实验证明
你的猜想?
|
实验现象 |
|
|
该气体的性质 |
|
|
你的猜想 |
|
|
你的实验 |
|
[点评]
通过实验,创设问题情景,引发学生探究欲望。
[活动与探究]二氧化碳气体的证明
学生上台演示实验。
[讨论与交流]
你还可以用什么事实或设计什么实验,来证明二氧化碳的密度比空气大?
学生讨论交流:①一个两端(均有纸筒)已平衡的天平,往一端纸筒中倾倒二氧化碳,天平向倒入二氧化碳的纸筒一端倾斜;
②同体积气球充入二氧化碳比充入空气下沉得快;
③二氧化碳可用来灭火;
④收集满二氧化碳的集气瓶要正放在桌面上;……
若学生答得不全,教师补充。如:“屠狗洞”的故事。
[引入与过渡]
二氧化碳除了是无色无味的气体,密度比空气大外,还有哪些性质?
[问题与情景]
[实验6-5]:猜想:如果将水倒入集满二氧化碳的质地较软塑料瓶中,立即旋紧瓶盖,振荡,你会看到什么现象?
实验:你观察到什么实验现象?
结论:从该实验说明中你获取了什么结论?
|
你的猜想 |
|
|
实验现象 |
|
|
获取的结论 |
|
[联想与应用]
请你再例举出一些生活事实,说明二氧化碳能溶于水。
[问题与情景]
①在[实验6-5]中塑料瓶为什么会变瘪?请说出你的理由?
②那位同学对上述理由需要提出质疑的?
 ③二氧化碳溶于水的过程中,与水发生了化学反应没有?
③二氧化碳溶于水的过程中,与水发生了化学反应没有?
补充实验
1:如右图,用试管取塑料瓶中液体少许,向试管中滴加
紫色石蕊溶液,观察实验现象。
(塑料瓶中的液体能使紫色石蕊变红。)
问题:是什么物质使紫色石蕊变红呢?请你大胆进行猜想。
猜想:①可能是二氧化碳使紫色石蕊变红。
②可能是水使紫色石蕊变红。
③可能是二氧化碳和水发生了化学反应,其生成的产物使紫色石蕊变红。……
设计实验:请根据自己的猜想,设计一个实验来进行验证。
讨论交流:请小各组展示实验方案。
实验探究:选择学生中有代表性的一组(如类似课本P114页[实验6-6];若学生未想到,教师就引导学生通过评价自己的方案,引出课本的方案)
[活动与探究]
探究是什么物质使紫色石蕊变红。
预备实验:稀醋酸和稀盐酸是二种我们熟悉的酸,现分别向二朵用石蕊染成紫色的干燥的小花上喷稀醋酸和稀盐酸,你会看到什么现象?由此可得到什么结论?
|
实验现象 |
|
|
获取的结论 |
|
[实验6-6]:
|
实验 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
现象 |
|
|
|
|
|
结论 |
|
|
|
|
问题:从[实验6-6]中,你可获取哪些结论?
[点评]
通过实验,创设问题情景,引导学生经历“提出问题,进行猜想,设计方案,实验探究,获取结论、解释交流”这一探究过程,从而培养科学探究的意识和形成科学探究的方法。
[问题与情景]
从上述实验中可知,二氧化碳能与水反应生成碳酸。
CO2 + H2O == H2CO3
碳酸是否稳定呢?
[活动与探究]
补充实验2:将补充实验1中变红的溶液加热,观察现象。
|
实验现象 |
|
|
获取的结论 |
|
小结:碳酸不稳定,易分解。
H2CO3== CO2↑+ H2O
[问题与讨论]
我们还学习过二氧化碳的什么化学性质,请说出来。
小结:二氧化碳能与石灰水反应,使澄清石灰水变浓浑浊。
CO2 + Ca(OH)2 == CaCO3↓+ H2O
------这是实验室检验二氧化碳气体的方法
[联想与应用]
展示:一瓶长期盛放石灰水的试剂瓶。
问题:为什么长期盛放石灰水的试剂瓶瓶壁上会出现白膜?(教师引导观察后,让学生自己提出问题)
解答:略
[反思与小结]
①通过本节课的学习你知道二氧化碳的哪些性质?
②通过本节课的学习你还有哪些收获或启示?
[练习与巩固]
2、通过对一氧化碳和二氧化碳的结构、性质、用途相关知识的学习,学会观察和描述化学现象;进一步认识物质的结构决定其性质,物质的性质决定其用途的化学学习方法;培养学生从现象到本质,从感性到理性的科学认识方法。
课题3 二氧化碳和一氧化碳
[教学目标]
1、了解自然界中的碳循环,了解温室效应。知道二氧化碳的主要性质和用途。了解一氧化碳的性质和用途。知道一氧化碳有损人体健康。
比较实验室制取氧气和制取二氧化碳的方法,如反应原料的状态、反应原理、反应条件、制气体的反应装置、气体密度、气体溶解性、气体是否与水反应、制气体的收集装置及检验气体的方法,归纳出实验室制取气体的思路和方法。
|
实验室制取气体的思路和方法 |
制 O2 |
制 CO2 |
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|||
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|||
|
|
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com