
16.⑴FeS2、CuS
⑵4CuCl2-+O2+4H+=4Cu2++8Cl-+2H2O
⑶该温度下,硫酸铜的溶解度小于氯化铜
⑷3C+Fe2O3 2Fe+3CO
2Fe+3CO
⑸①SO2 + 2Fe3++ 2H2O=SO42-+ 2Fe2++ 4H+ ②12.00%
(每空2分,共12分)
18.⑴-746.5 kJ/mol
⑵①催化反应的温度 ②c
⑶B(每空2分,共8分)
17.(10分)利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 。
(2)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)= mol/L。(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 。与方法一相比,方法二的优点为 。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:CCl2=CHCl +·Cl→·CCl2CHCl2 ·CCl2CHCl2 + O2→·OOCCl2CHCl2
·OOCCl2CHCl2→·OCCl2CHCl2 + 1/2O2
·OCCl2CHCl2→CHCl2COCl +·Cl
该反应的总化学反应为 。
16.(12分)一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
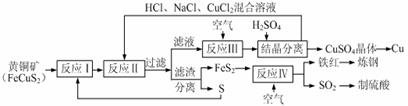 注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S 请回答下列问题:
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S 请回答下列问题:
(1)反应Ⅰ的产物为(填化学式) 。 (2)反应Ⅲ的离子方程式为 。
(3)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是 。
(4)炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是 。
(5)某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 。
②反应Ⅳ所得气体中SO2的体积分数为 。
18.(8分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol 2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol 尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
 (2)某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)
(2)某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)
条件下对汽车尾气的催化效果。
①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、 等必须相同。
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。]
空燃比约为 时,催化剂对汽车尾气的催化效果最好。
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为
氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
 下列说法错误的是 。A.负极的电极反应式为:CO+O2-―2e-=CO2
下列说法错误的是 。A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
28.⑴BC ⑵16(每空2分,共4分)
⑶①14 mol/L (3分)
②每小时生成的硝酸的质量m(HNO3)= 20 t×63%=12.6 t
根据总化学方程式:NH3+2O2=HNO3+H2O
每小时生成水m(H2O)1= 12.6 t×18/63=3.6 t
生成的硝酸中所含水的质量m(H2O)= 20 t-12.6 t=7.4 t
每小时从吸收塔淋下的水的质量m(H2O)2= 7.4 t -3.6 t=3.8 t (3分
训练三
27、(1)Al2O3 + OH- → 2AlO2- + H2O 1分
(2)Fe2O3 颜料 冰晶石 熔剂(使Al2O3易熔融) (每空1分)
(3)加热浓缩或蒸发浓缩 冷却结晶 过滤洗涤 3分
(4)CaO、CO2 2分
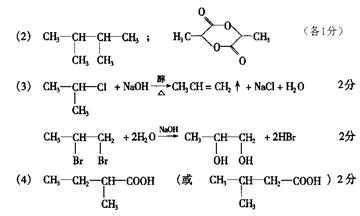
26、(1)产生气泡的快慢(1分), 消除阴离子不同对实验的干扰(1分),
(2)分液漏斗(1分), 关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位。(2分)
产生40mL气体所需的时间(1分)
(3)①2H2O2  2H2O + O2↑(1分);②60 mL (1分); ③1 min (1分) ;④2.5 min(说明:只要答2.5~2.6min同样给分,1分); ⑤D>C>B>A (1分);
2H2O + O2↑(1分);②60 mL (1分); ③1 min (1分) ;④2.5 min(说明:只要答2.5~2.6min同样给分,1分); ⑤D>C>B>A (1分);
⑥随着反应的进行,浓度减小,反应速率减慢 (1分) ⑦ 0.11 mol·L-1 (2分)
25、(1)[NO]4[H2O]6/[NH3]4[O2]5 (1分) 减小(1分) (2)c(2分)
(3)①可增大NH3的转化率(1分) ②0.1875 (1分)
③a、b (2分) ④增加反应物的浓度(1分)
28.(10分)右图为工业制备硝酸的设备示意图,其生产过程中发生的反应主要有:
①4NH3(g)+5O2(g) 4NO(g) +6H2O(l) △H<0②2NO(g)+O2(g) 2NO2(g) △H<0
③3NO2(g)+H2O(l) 2HNO3(l) +NO(g) △H<0
(1)能使吸收塔内反应速率增大,且能提高HNO3产率的措施是 。
A.适当升高温度B.适当增大吸收塔内的压强C.增大空气中O2的浓度
D.吸收塔内填充瓷环,增大气液接触面
(2)在2L密闭容器内充入0.50 mol NO和0.25 mol O2,维持反应温度为800℃,当反应达到平衡时,NO的转化率为50%。则800℃时反应2NO+O2=2NO2的平衡常数K= 。 (3)某工厂每套设备每小时可生产20 t 63%的硝酸(密度为1.4 g/cm3)。假设工业生产硝酸过程中,通过循环操作可以使NH3、O2得以完全利用。回答下列问题:①该工厂设备所生产硝酸的物质的量浓度是 。②每小时从吸收塔淋下的水的质量应是多少吨?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com