
27.(14分)化合物A是一种重要的光化学试剂,属不含结晶水的复盐。A-H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
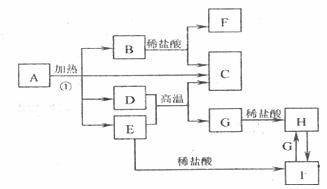
已知:A中含二种阴离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3:1:3。阴离子中各元素的质量分数与C相同且式量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,1能使苯酚溶液显紫色。
回答下列问题:
(1)C的电子式 。
(2)A的化学式 。
(3)D+E→C+G的方程式 。
(4)H+H2O2→I的离子反应方程式 .
(5)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去。而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是 。
26.(1)(3分)配平:
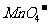 +
+ 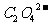 +
+ 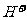 --
-- 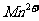 +
+ 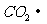 +
+ 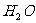
(2)(9分)某主族元素R的单质可被稀硝酸氧化为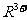 。
。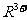 最外层有两个电子,在碱性条件下,
最外层有两个电子,在碱性条件下,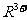 可被
可被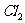 氧化成带一个单位负电荷的含氧酸根阴离子,该阴离子在酸性条件下能将
氧化成带一个单位负电荷的含氧酸根阴离子,该阴离子在酸性条件下能将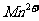 氧化成
氧化成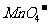 ,同时本身又被还原为
,同时本身又被还原为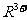 :试写出有关反应的离子方程式(不必确定R为何元素);
:试写出有关反应的离子方程式(不必确定R为何元素);
① ;
② ;
③ 。
(3)(6分)-个完整的氧化一还原反应式可以拆写成两个“半反应”,一个是氧化反应,另一个是还原反应;
如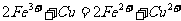 拆写的结果是:氧化反应:
拆写的结果是:氧化反应: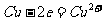 ;还原反应:
;还原反应: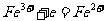 ,据此,要将反应
,据此,要将反应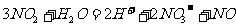 拆写成两个“半反应”式:
拆写成两个“半反应”式:
氧化反应:
还原反应:
13.在一密闭容器中充入2mo1A和l molB发生反应:2A(g)+B(g) xC(g),达到平衡后,C的体积分数为W%:若维持容器的容积和温度不变,按起始物质的量 A:0.6mol B:0.3mol C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为
xC(g),达到平衡后,C的体积分数为W%:若维持容器的容积和温度不变,按起始物质的量 A:0.6mol B:0.3mol C:1.4mol充入容器,达到平衡后,C的体积分数仍为W%,则x值为
A.只能为2 B.只能为3
C.可能是2,也可能是3 D.无法确定
第Ⅱ卷
12.下列关于溶液中离子的说法正确的是
A.0.1 mol·L-1的Na2CO3溶液中离子浓度关系:
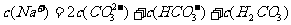
B.0.1 mol·L-1的NH4Cl和0.1 mol·L-1的NH3·H2O等体积混合后溶液中的离子浓度关系: 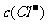 >
>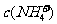 >
>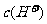 >
>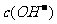
C.常温下,醋酸钠溶液中滴加少量醋酸使溶液的Ph=7,则混合溶液中,
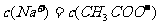
D.常温下,pH=1的溶液中,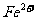 、
、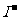 、
、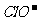 、
、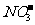 能够大量共存
能够大量共存
11.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)lmol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示;现提供以下化学键的键能(KJ/mo1):P-P 198KJ/mol,P-O 360KJ/mol,O-O 498 KJ/mol,则反应P4(白磷)(s)+3 O2(g)= P4O6(s)的反应热△H为
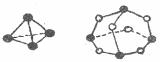
A.+1638KJ/mol B.一1638KJ/mol
C.一126KJ/mol D.+126KJ/mol
10.用Na2SO3还原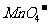 ,如果还原舍有
,如果还原舍有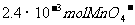 的溶液时,消耗30mL 0.2mol/LNa2SO3溶液,则Mn元素在还原产物中的化合价是
的溶液时,消耗30mL 0.2mol/LNa2SO3溶液,则Mn元素在还原产物中的化合价是
A.+1 B.+4 C.+2 D.+5
9.某溶液中含有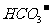 、
、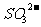 、
、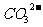 、
、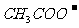 等四种阴离子。向其中加入足量的Na2O2粉末后,溶液中离子的浓度基本保持不变的是(不考虑溶液在反应前后的体积变化)
等四种阴离子。向其中加入足量的Na2O2粉末后,溶液中离子的浓度基本保持不变的是(不考虑溶液在反应前后的体积变化)
A.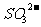 B.
B.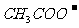 C.
C.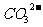 D.
D.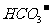
8.已知硫酸锰(MnSO4)和过量过硫酸钾(K2S2O8)两种盐溶液在Ag+催化下可发生氧化还原反应.生成高锰酸钾、硫酸钾和硫酸。则下列说法正确的是
A.反应中水参加反应 B.反应后溶液呈无色
C.该反应的还原刹为K2S2O8 D.MnSO4和K2S2O8的化学计量数分剐为5、2
7.设NA为阿佛加德罗常数,下列叙述中正确的是
A.0.5L1mol/L,FeCl3溶液中含Fe3+总数为0.5NA
B.1L 1mol/L醋酸溶液中离子总数为2NA
C.标准状况下 22.4L H2中含中子数为2NA
D.46g NO2和N2O4混合气体中含有原子数为3NA
6.下列物质属于强电解质且能导电的是:①氯化钠溶液 ②氯化铵固体 ③铜 ④石墨⑤熔融
NaOH ⑥稀硫酸 ⑦乙酸 ⑧乙醇
A.⑤ B.②⑤ C.①②⑤⑥ D.①③④⑤⑥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com