
11.下列物质在溶于水和熔化时,克服的作用力完全相同的是 ( )
A.干冰 B.KOH C.NaHSO4 D.冰醋酸
10.下列离子在溶液中因氧化还原而不能大量共存的是 ( )
A.H3O+、NO3-、Fe2+、Na+ B.Ag+、NO3-、Cl-、K+
C.K+、Ba2+、OH-、SO42- D.Cu2+、NH4+、Br-、OH-
9.白磷与氧可发生如下反应:P4+5O2=P4O10.已知断裂下面化学键需要吸收的能量分别为:
P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1根据图示的分子结构
和有关数据估算该反应的△H,其中正确的是( )
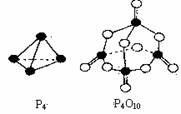
A.(6a+5d-4c-12b)kJ·mol-1 B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1 D.(4a+5d-4c-12b) kJ·mol
8.在浓盐酸中H3AsO3与SnCL2反应的离子方程式为:
SnCl2+Cl-+H3AsO3=H+-As+SnCl62-+M(未配平),关于该反应的说法中正确的组合是 ( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成0.1mol的As,还原剂失去的电子为0.3mol ④M为OH- ⑤SnCl62-是氧化产物 ⑥H+前面的配平系数为6
A.①③⑤⑥ B.①②④⑤ C.①②③④ D.只有①③⑥
7.下列反应的离子方程式正确的是 ( )
A.次氯酸钙溶液中通入过量的二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.用氨水吸收少量二氧化硫:NH3·H2O+SO2=NH4++HSO3-
C.碳酸氢镁溶液加入过量澄清石灰水:
Ca2++Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CaCO3↓
D.氢碘酸中通入氯气:2I-+Cl2=2Cl-+I2
6.限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐相互反应,符合离子方程式:
2H++SO32-=H2O+SO2↑的化学方程式个数有 ( )
A.4 B.6 C.8 D.12
5.下列关系图中,A是一种正盐,B是一种气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转换化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量的B跟CL2反应除生成C外,另一产物是盐酸盐。
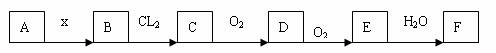
下列说法中不正确的是 ( )
A.当X是强酸时,A、B、C、D、E、F中均含同一元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一元素,F可能是HNO3
C.当X是强酸时,C在常温下是气态单质
D.B和Cl2的反映是氧化还原反应
4.已知:SO32-+I2+H2O=SO42-+2H++2I-,其溶液中可能含有I-,NH4+,Cu2+,SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列该溶液组成的判断正确的是 ( )
A.肯定含有I-,可能含有SO32- B.肯定不含Cu2+,可能含有I-
C.可能含有SO32- D.肯定不含Cu2+、I-
3.下列各选项所述的两个量,前者一定大于后者的是 ( )
①F2和Br2的沸点 ②纯水在25℃和80℃时的pH值 ③同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量 ④25℃时,等体积且pH都等于5的盐酸和ALCl3溶液中,已电离的水分子数 ⑤在NH3+NO→N2+H2O(未配平)反应中,被氧化和被还原的N原子数⑥H-和H+的离子半径
A.①②④ B.②③⑥ C.②⑥ D.⑤⑥
2.目前,人类已经发现的非金属元素除稀有气体元素外共有16种。下列对这16种非金属元素的说法正确的是 ( )
①都是主族元素,最外层电子数都大于3②单质形成的晶体都为分子晶体③氢化物常温下都是气态,所以又叫做气态氢化物④氧化物常温下都可以与水反应生成酸
A.只有①②正确 B.只有①③正确 C.只有③④正确 D.①②③④都不正确
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com