
2.生活中常用到一些化学知识,下列分析中正确的是 ( )
A.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水
B.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
C.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
D.误食重金属盐会中毒,是因为重金属盐能使蛋白质盐析
1.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是 ( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液
④根据反应中的热效应将化学化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
29.(17分)
I.硫酸的消费量常被作为一个国家工业发展水平的一种标志。下表为接触法制硫酸时,温度和压强对SO2转化的影响:
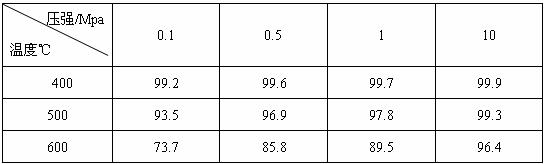
(1)硫酸工业在国民经济中占有重要的地位,请写出它的两种重要用途(2分):
、 。
(2)工业中催化氧化SO2采用常压而不用高压,理由是:
。(2分)
II.实验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并收集得到SO3。已知SO3熔点为16.8℃,沸点44.8℃,且SO3遇水剧烈反应。
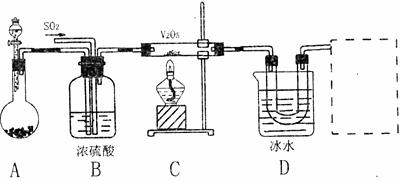
(1)写出A装置中制取氧气的化学方程式(2分) 。
(2)B装置的作用除了将气体混合外,还有(4分)
① 。
② 。
(3)加热硬质玻璃管时,若不断升高温度,对SO2和O2生成SO3的化学反应有何影响(2分) 。
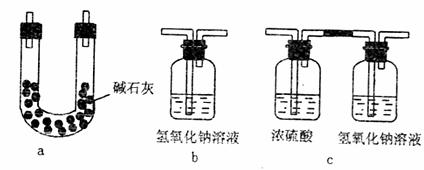
(4)本实验装置虚框处还需接一装置,甲、乙、丙三同学分别设计了a、b、c三套装置,你认为不合理的是(2分) ,理由是 。(3分)
28.已知A、B、D、E均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)(13分)。
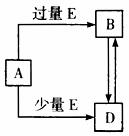
(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①(2分)B属于 分子(填“极性”或“非极性”),B分子中各原子最外层 (填“是”或“否”)都满足8电子结构;
②向50 mL 4mol/L的NaOH溶液中通入1.12LB(标准状况),反应后溶液中溶质的物质的量之比为 (填化学式和物质的量之比);
③4gA单质完全燃烧放出131.2kJ的热量,写出表示A单质燃烧的热化学方程式
。
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式 ;
②写出A和B的溶液反应的离子方程式 。
(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象。已知:X为含有非极性键的离子化合物,且1molX含有38mol电子,向D溶液中加入与D等物质的量的X的固体,恰好完全反应,写出该反应的离子方程式 。
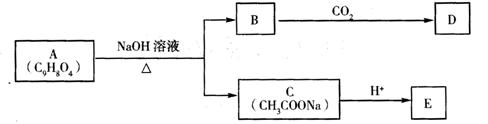
27.(18分)A是药用有机物,A的转化关系如下图所示。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上,D能跟NaOH溶液反应。
请回答:
(1)A转化为B、C时,涉及到的反应类型有(2分) 、 。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q 、R 。
(3)D的结构简式为 。
(4)写出A在加热条件下与NaOH溶液反应的化学方程式 。
(5)已知:酰氯能与含有羟基的物质反应生成酯类物质,例如:
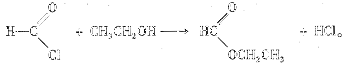
写出草酰氯(分子式C2O2Cl2,结构式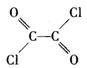 )与足量有机物D反应的化学方程式
。
)与足量有机物D反应的化学方程式
。
(6)已知: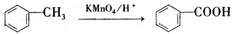
请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
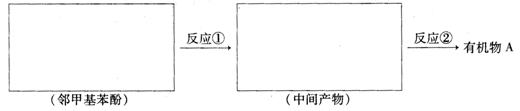
26.(12分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A和B两元素也可以形成18个电子的化合物M,则 M的电子式为(2分): 。
(2)由C和E所形成的化合物中含有的化学键是(2分) ,该经合物属于(2分) 晶体(填晶体类型)。
(3)收A、B、C、D四种元素所形成的两种化合物之间相互反应的离子方程式为(3分) 。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程总反应方程式为(3分) 。
13.不久前,美国一个海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃-700℃,所用燃料为H2,电解质为熔解的K2CO3,已知该电池的总反应为:2H2+O2 2H2O,负极反应为:H2+CO32--2e-
H2O+CO2,则下列推断中正确的是 ( )
A.电池供应1mol水蒸气,转移4mol电子
B.正极反应为4OH- O2+2H2+4e-
C.O2从正极通入,发生氧化反应
D.该电池的电极没有参加反应
第Ⅱ卷(非选择题)
12.反应X(g)+3Y(g) 2Z(g);H<0在不同温度、不同压强(P1<P2)下,达到平衡时,混合气体中Z的体积分数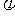 (Z)随温度变化的曲线应为 ( )
(Z)随温度变化的曲线应为 ( )
A B C D
11.某有机物A是农药生产中的一种中间体,其结构简式为:
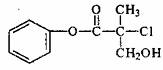
关于A的 叙述正确的是 ( )
A.属于芳香烃 B.一定条件下可以生加成反应和消去反应
C.1molA可以与2mol NaOH反应 D.易溶于水
10.下列各组离子在相应的条件下一定能大量共存的是 ( )
A.25℃时,在c(H+)/c(OH-)=1×1012的溶液中:NH4+、Ca2+、C1-、K+
B.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
C.在碱性溶液中:CO32-、K+、C1-、Ca2+
D.在pH=1的溶液中:A13+、Fe2+、SO42-、C1O-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com