
28.(13分)已知有一白色粉末是由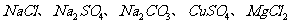 中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
中的一种或几种组成。某同学欲探究这一粉末的组成,做了如下实验:
①取少量粉末,加水溶解,得无色透明溶液;
②取①中溶液少量,加入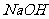 溶液,无明显现象发生;
溶液,无明显现象发生;
③另取少量粉末,加入稀盐酸,无明显现象发生。
(1)请你根据该同学实验所得现象,推测这一粉末的可能组成是
__________________________________________________________
(2)若推测该粉末只由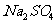 组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有:
组成,请你在该同学实验基础上设计后续实验,以确定这包粉末的组成。[可供选择的试剂有: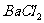 溶液、
溶液、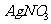 溶液、稀
溶液、稀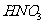 、NaOH溶液、
、NaOH溶液、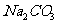 溶液、
溶液、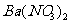 溶液、稀盐酸]
溶液、稀盐酸]
|
实验步骤 |
实验现象 |
反应离子方程式和结论 |
|
④ |
|
|
注:实验步骤的序号由你顺序编号。实验现象、离子方程式和结论要与相应的实验步骤一一对应。
27.(7分)物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D.E为单质,试回答:
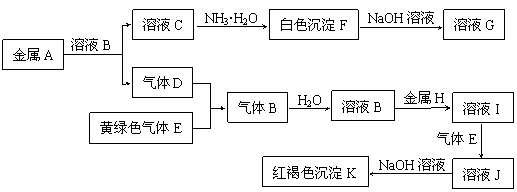

(1) 写出下列物质的化学式:A是 ,B是 ,D是 ,K是 ;
(2) 写出反应“C→F”的离子方程式: ;
(3)写出反应“F→G”的化学方程式: ;
(4) 写出反应“I→J”的化学方程式: 。
26.(8分) Fe2O3和Cu2O 都是砖红色粉末,课外小组通过实验探究某砖红色粉末是Fe2O3、Cu2O或者是二者混和物。探究过程如下:
查阅资料:Cu2O是碱性氧化物,Cu2O与H+反应生成的Cu+不稳定,立即转化成Cu2+和Cu。
提出假设:假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末为Fe2O3、Cu2O的混和物
设计探究实验
取少量粉末,向其加入足量稀HCl在所得溶液中滴加苯酚溶液
(1)若假设1成立,则实验现象是
(2)若滴加苯酚后溶液不变紫色,则证明原固体粉末不含Fe2O3。你认为结论是否合理______ (填合理或不合理)简述理由
(3)若固体粉末完全溶解无固体存在,滴加苯酚时溶液不变紫色,证明原固体粉末是________相关的离子方程式为
25.(4分)汞单质及其化合物在工业生产和科学实验中有广泛的用途,汞的矿源是朱砂(HgS)。朱砂炼汞的反应之一为(在加热条件下进行):HgS + O2 = Hg + SO2
请回答:
HgS与O2的反应中,氧化剂是 ,每生成1molHg转移电子的物质的量为
24.在氧气中灼烧0.44g硫和铁组成的化合物,使其中的硫全部转变为二氧化硫,把这些二氧化硫全部氧化并转变为硫酸.这些硫酸可以用20.00mL0.50mol/L氢氧化钠溶液完全中和.则原化合物中硫的质量分数为 ( )
A.18% B.46% C.53% D.36%
第II卷(非选择题 共40分)
23.设阿伏加德罗常数(NA)的数值为nA,下列说法错误的是 ( )
A.1.5molNO2与足量的水反应,转移电子数为nA
B.10mL质量分数98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
C.在H2O2 + Cl2 = 2HCl + O2反应中,每生成32g氧气,转移2nA个电子
D.标况下,分子数为nA的CO2、N2O混合气体的体积约为22.4L,质量为44g
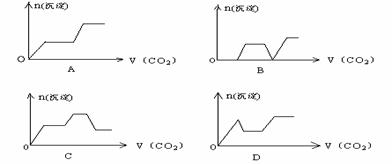
22.将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为: ( )
21.工业上用黄铜矿(CuFeS2)炼铜的后期主要发生如下两个反应(假设两反应进行的很完全):
2Cu2S + 3O2 = 2Cu2O + 2SO2
2Cu2O + Cu2S = 6Cu + SO2
根据以上两个化学反应,判断下列说法不正确的是 ( )
A.氧化剂与还原剂的质量之比为17:15
B.工业炼铜时应注意控制向炉内通入氧气的量
C.若制取3molCu,转移电子物质的量为8mol
D.工业炼铜可以和硫酸工业联合建厂
20.已知M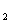 O
O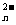 离子可与R
离子可与R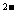 离子作用,R
离子作用,R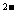 被氧化为R单质,M
被氧化为R单质,M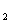 O
O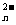 的还原产物中,M为+3价;又如c(M
的还原产物中,M为+3价;又如c(M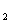 O
O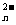 )=0.3 mol·L
)=0.3 mol·L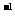 的溶液100 mL可与c(R
的溶液100 mL可与c(R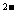 )=0.6 mol·L
)=0.6 mol·L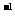 的溶液150 mL恰好完全反应,则n值为 ( )
的溶液150 mL恰好完全反应,则n值为 ( )
A.4 B.5 C.6 D.7
19.一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能反应,化学方程式分别如下:2AtI + 2Zn = ZnI2 + ZnAt2 AtI + 2NH3(l) = NH4I + NH2At则下列叙述正确的是 ( )
A.ZnI2即是氧化产物又是还原产物
B.ZnAt2即是氧化产物又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂
D.AtI与液氨反应,是自身氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com