
27.(15分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
①称取a g样品,置于烧杯中;
②加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
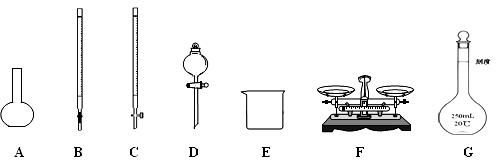
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和 (填仪器序号)。
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤沉淀的操作是 。
(4)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是 。
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为 。
选考题(15分)
26.(16分)现有物质A-I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(反应中生成的其它物质已略去)
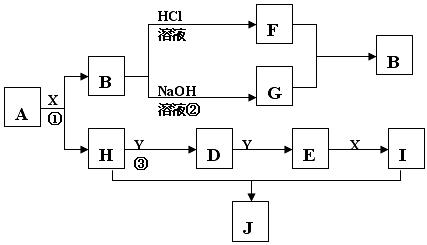
根据上述转化关系图回答:
(1)写出下列物质的化学式X:___________J:_____________
(2)物质H的电子式______________,物质J中的化学键类型有______________
(3)写出反应①的化学方程式__________________________________,
写出反应②的离子方程式___________________________________,
写出反应③的化学方程式____________________________________。
25.(12分)如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定)。试回答下列问题:
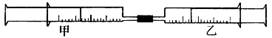
|
实验序号 |
甲针筒内物质 |
乙针筒内物质 |
甲针筒的现象 |
|
1 |
10mL FeSO4溶液 |
10mL NH3 |
生成白色沉淀,后变色 |
|
2 |
20mL H2S |
10mL SO2 |
|
|
3 |
30mL NO2(主要) |
10mL H2O(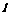 ) ) |
剩有无色气体,活塞自动向内压缩 |
|
4 |
15mL Cl2 |
40mL NH3 |
|
(1)实验1中,沉淀最终变为________色,写出沉淀变色的化学方程式_____________。
(2)实验2甲针筒内的现象是:有_________生成,活塞________移动(填向外、向内、不)。反应后甲针筒内有少量的残留气体,正确的处理方法是将其通入_____溶液中。
(3)实验3中,甲中的30mL气体是NO2和N2O4的混合气体,那么甲中最后剩余的无色气体是_______,写出NO2与H2O反应的化学方程式为____________________。
(4)实验4中,已知:3Cl2+2NH3 N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为________。最后针筒内剩余气体的体积约为_______mL。
N2+6HCl。甲针筒出活塞有移动,针筒内有白烟产生外,气体的颜色变为________。最后针筒内剩余气体的体积约为_______mL。
13.NA表示阿佛加德罗常数。下列说法中正确的是 ( )
A.200mL 1mol/L Fe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
B.在常温常压下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3NA
C.标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为1.5NA
D.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
第Ⅱ卷(共174分)
12.以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂,以下可作为缓蚀剂添加的是 ( )
A.KMnO4 B.NaNO2 C.FeCl3 D.HNO3
11.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列有关说法中,不正确的是 ( )
A.NH5中既有离子键又有共价键
B.NH5的熔沸点高于NH3
C.1mol NH5中含有5mol N-H键
D.NH5固体投入少量水中,可产生两种气体
10.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O = 3Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O = Fe3O4+4NaOH;
下列说法不正确的是 ( )
A.反应①②③均是氧化还原反应
B.反应②中的氧化剂是NaNO2
C.该生产过程会产生污染
D.整个反应过程中每有16.8g Fe参加反应转移0.8mol电子
9.北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)。为了验证他们的猜想,请你选择一种试剂来证明甲、乙、丙猜想的正误( )
A.硫酸铜溶液 B.稀硝酸
C.盐酸 D.硝酸银溶液
8.在一定条件下,将钠与氧气反应的生成物2.8g溶于水,所得溶液恰好能被80mL浓度为1.0mol/L的HCl溶液中和,则生成物的成分是 ( )
A.Na2O B.Na2O2 C.Na2O和Na2O2 D.Na2O2和NaO2
7.下列叙述不正确的是 ( )
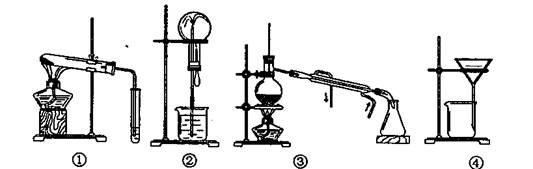
A.可用装置①鉴别碳酸钠和碳酸氢钠
B.可用装置②证明氨气极易溶于水
C.可用装置③从海水中得到淡水
D.可用装置④把胶粒从溶液中分离出来
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com