
20.(10分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,而且对周边环境不构成任何污染。这一材料是由江苏华信塑业发展有限公司最新研发成功的新材料,并成为公安部定点产地。PETG的结构简式为:
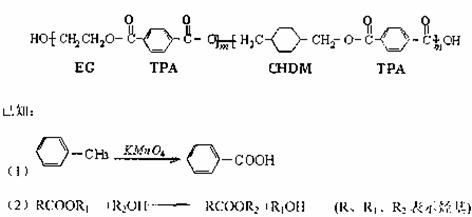
这种材料可采用以下合成路线:
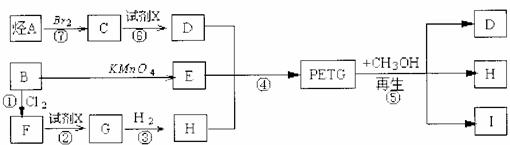
试回答下列问题:
(1)反应②⑥加入的试剂x是 。
(2)⑤的反应类型是 。
(3)写出结构简式:B I 。
(4)合成时应控制的单体的物质的量
n(D):n(E):n(H): : : (用m、n表示)
(5)写出化学方程式:
反应③:
反应⑥:
19.(13分)回答下列问题

(1)在上表中用实线补全周期表的边界。
(2)元素③、④形成的氢化物熔沸点高的是 (用氢化物的化学式表示)原因是 。用反应方程式证明③、⑤的非金属性强弱 。
(3)A、B两种化合物均由①②③④四种元素组成,写出此两种化合物在水溶液中发生反应的离子方程式 。
(4)④单质在空气中燃烧生成x,已知一定条件下16gX被氧气氧化放出24.5KJ热量, 写出X燃烧的热化学反应方程式 。
(5)元素周期表中位置相近就会有某些相似的性质,如⑥、⑦两元素也有一些相似的化学性质,请举例蜕明⑥、⑦元素的相似性(用化学方程式表示): 。
(6)下图是高中化学课本中的实验装置图。
a用元素符号标出铁在周期表中的相应位置。
b装置B中有关反应的化学方程式为 。
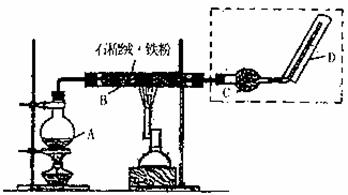
c将②、③两元素形成的含非极性共价键的化合物投入氯化亚铁溶液中,会立即观察到红褐色沉淀,同时有无色气泡。写出红褐色沉淀与气体是2:1时的离子方程式: 。
17.(5分)氰(CN)2的化学性质与卤素很相似(X2),称为拟卤素。氰能和氢气反应生成HCN,其水溶液是一种酸。氰的氧化性比溴弱,比碘强。
(1)HCN分子中含有4个共价键,写出HCN的结构式
(2)KCN溶液显碱性,原因是(用离子方程式表示)
(3)下列有关方程式不正确的是 。
A.(CN)2+2NaOH=NaCN+NaCNO+H2O
B.MnO2+4HCN Mn(CN)2+(CN)2+2H2O
Mn(CN)2+(CN)2+2H2O
C.I 2+2KCN=2KI+(CN)2
D.向NaBraq和KCNaq中加入少量Cl 2:Cl 2+2NaBr=2NaCl+Br2
(4)处理CN的工业废水常用C10-氧化处理生成CNO-。反应的离子方程式如下:
a CN-+bC1O-+2 cOH-=d CNO-+e N2+fCO32-+b Cl-+c H2O
上述化学方程式可能的配平系数有多组。
①方程式中e:f的值为 。
A.1 B.1/2 C.2 D.不能确定
②若d=e=1,则b= 。
16.(6分)常温下有浓度均为0.5m01/L的四种溶液:①Na2CO3;②NaHCO3.③HC1④Na3·H2O
(1)上述溶液中,可发生水解的是 (填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度大到小的顺序为 。
(3)向溶液④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值 (填增大、减小、不变)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积 ④的体积(填大于、小于、等于),此时溶液中离了浓度由大到小的顺序是 。
(5)取10mL溶液③,加水稀释到500mL。,则该溶液中由水电离出的c(H+)= 。
15.将11.9gMg-A1 – Fe组成的合金溶于足量的NaOH溶液中,合金质量减少2.7g。另取等质量的合金溶于过量稀硝酸中,生成6.72L(标准状况)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、A13+、Fe3+完全转化为沉淀,则沉淀质量为( )
A.22.1 B.27.2 C.30 D.无法确定
第Ⅱ卷(非选择题 共55分)
14.实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“NazS”字样。已知固体M只可能是Na2S、Na2SO3、 Na2SiO4、Na2SO4、Na2S2O3中的一种。若取少量固体M配成溶液进行有关实验,下列说法中不正确的是 ( )
A.向溶液中加稀硝酸酸化的BaC12,若有白色沉淀,则固体M为Na2SO4
B.向溶液中通入CO2,若有白色沉淀,则固体M为Na2SiO3
C.用pH试纸检验,若pH=7则固体M一定是Na2SO4
D.只用盐酸一种试剂就可以确定该固体M的具体成分
13.下列关于四个图像的说法正确的是 ( )
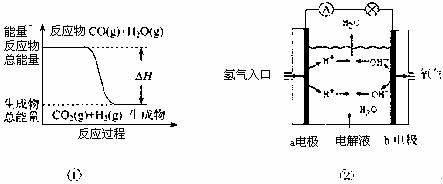
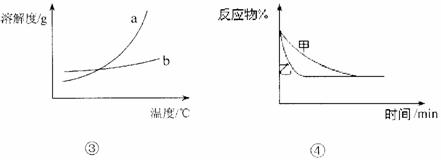
A.图①表示化学反应中能量的变化,反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H>0
B.图②为氢氧燃料电池示意图,正、负极通入的气体体积之比为2:1
C.图③表示物质a、b的溶解度曲线,可以用结晶方法从a、b混合物中提纯a
D.图④可以表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,且乙的压强大
12.下列溶液中有关微粒的物质的量浓度关系正确的是 ( )
A.NaHSO3和NaHCO3的中性混合溶液中(HSO3-和HCO3-均R用表示):
c(Na+)=c(HRO3-)+2c(RO32-)
B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
c(Na+)>c(Cl-)>c(CH3COO-)
C.常温下物质的量浓度相等的①(NH4)2CO3、 ②(NH4)3SO4、 ③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>①>②
D.等体积等物质的量浓度的NaC1O与NaCl溶液中离子总数多少:N(NaClO)>N(NaCl)
11.下图为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述中正确的是( )
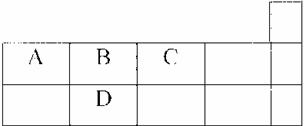
A.原子半径大小比较为A>B>C>D
B.A、B、C、D的单质在常温下均不导电
C.生成氢化物的稳定性A>B>C>D
D.A与C形成的阴离子可能有AC32-、A2C42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com