
29.(15分)硅单质及其化合物应用范围很广。
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅:
Ⅰ、高温下用碳还原二氧化硅制得粗硅
Ⅱ、粗硅与干燥的氯气在450 ℃-500 ℃ 反应制得SiCl4
Ⅲ、SiCl4液体经精馏提纯后与过量H2在1100 ℃-1200 ℃ 反应制得纯硅
已知SiCl4沸点为57.6 ℃,能与H2O强烈反应。1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ。请回答下列问题:
①第Ⅰ步制备粗硅的化学反应方程式为 ,第Ⅲ步反应的热化学方程式是 。
②整个制备纯硅过程必须严格控制无水无氧。SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是 ;H2还原SiCl4过程中若混O2,可能引起的后果是 。
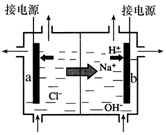
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如下图所示),其中进入阳极室的溶液是 ,b电极上的电极反应式是 。
(2)二氧化硅大量用于生产玻璃。工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x= 。
28.(15分)烃的含氧衍生物A、B能发生如下转化:
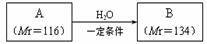
已知A分子中C、H、O三种元素的原子个数比为1:1:1。实验表明A能使溴水褪色,1mol A与足量NaHCO3溶液反应放出2 mol CO2。请回答:
(1)A分子所含官能团的名称是 ,B的分子式是 。
(2)A与氢溴酸反应只能得到一种产物,则A的结构简式是 。
(3)B在浓硫酸作用下既能与乙醇,又能与乙酸发生酯化反应。B与过量乙醇反应的化学方程式是 ,B与乙酸反应生成的酯结构简式是 。
(4)B失去1分子水后能形成一种四元环状化合物C,C的结构简式是 。
(5)写出与B含相同官能团的B的同分异构体结构简式: 。
27.(14分)下图表示几种无机物之间的转化关系。其中A、B均为黑色粉末,C为无色气体,E是红棕色气体,G是具有漂白性的气体,H的水溶液呈蓝色。
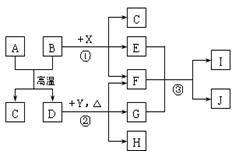
请回答下列问题:
(1)A的化学式是 ,C的电子式是 ,Y的名称是 。
(2)反应①的化学方程式为 。
(3)实验室测定气体E的相对分子质量时,得到的实验值总是比理论值偏大。要准确测定E的相对分子质量,最适宜的条件是_________。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(4)用石墨作电极电解H的水溶液,电解总反应的离子方程式是 。
(5)推测反应③的还原产物可能是 。
26.(16分)某研究性学习小组在查阅资料时发现,化工厂常用氨气来检验氯气是否泄漏,于是它们设计实验来探究氯气与氨气之间的反应。该小组设计的实验装置如下图:
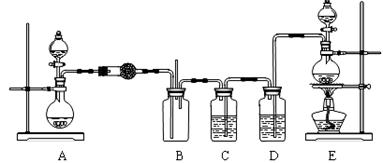
实验可用药品有:a. 二氧化锰 b. 浓盐酸 c. 浓氨水 d. 氯化铵 e.碱石灰 f.浓硫酸 g. 饱和食盐水 h. NaOH固体 i.消石灰
请回答下列问题:
(1)实验室制备氨气有多种方法。通常用加热固体混合物的方法制备氨气,反应的化学方程式是 ,本实验中装置A烧瓶内的固体可选用 (填上述给定药品的序号)。
(2)装置E的烧瓶中发生反应的化学方程式是 。
(3)装置D中盛装的药品是 (填序号),装置C的作用是 。
(4)通入B装置的两根导管左边的较长、右边的较短,其目的是 。
(5)实验中观察到装置B内出现浓厚的白烟,并在容器壁上凝结成白色固体,将该固体溶于水,所得溶液中离子浓度由大到小的顺序为 。
(6)已知,在水溶液中能发生反应3Cl2+2NH3===N2+6HCl,如果氯气过量,一种产物分子的空间构型与NH3相似,该反应的化学方程式是 。
13.常温下,将1.92gCu加入到100mL硫酸和硝酸的混合溶液中,铜全部溶解并放出无色气体,再向该溶液中加入足量的Fe粉充分反应,此时收集到的气体全部是氢气且在标准状况下的体积为448mL。下列说法中正确的是
A.原混合液中n(NO-3)=0.08mol B.原混合液中c(SO2-4 )=0.2mol/L
C.原混合液中pH=1-lg1.2 D.溶解的Fe粉质量为2.8g
第Ⅱ卷(非选择题)
12.反应C(s)+CO2(g)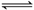 2CO(g);∆H=+172.5 kJ·mol-1,描述平衡体系的物理量y随温度或压强(用x表示)的变化关系如图所示。下列判断正确的是
2CO(g);∆H=+172.5 kJ·mol-1,描述平衡体系的物理量y随温度或压强(用x表示)的变化关系如图所示。下列判断正确的是
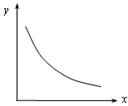
A.x表示压强,y表示平衡混合物中CO2的转化率
B.x表示压强,y表示混合气体的平均分子量
C.x表示温度,y表示平衡混合物中CO2的转化率
D.x表示温度,y表示平衡混合物中CO的体积分数
11.下列说法正确的是
A.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3
B.在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变
C.0.1 mol/L CH3COOH溶液在稀释过程中将变小
D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀
10.目前国家仍允许在面粉中添加过氧化苯甲酰来使面粉增白,但它的安全性已引起公众质疑。已知过氧化苯甲酰能发生如下反应:
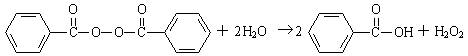
下列叙述不正确的是
A.并非在食品中添加任何化学物质都对人体有害
B.过氧化苯甲酰能使面粉增白的原因是它与水反应生成的H2O2具有漂白性
C.苯甲酸的同分异构体中,既属于醛又属于酚的物质有4种
D.甲苯经两步取代反应和两步催化氧化反应可转化为苯甲酸
9.下列实验方案可行的是
A.用氨水清洗做过银镜反应的试管
B.用溴水鉴别苯、乙醇、四氯化碳三种液体
C.除去苯中的苯酚,加饱和NaHCO3溶液再分液
D.向氯乙烷中加入硝酸酸化的AgNO3溶液来检验Cl-
8.在下列溶液中一定能够大量共存的离子组是
A.使酚酞试液变红的溶液:Na+、Cl-、SO2-4 、Cu2+
B.在pH=1的溶液中:Fe2+、Mg2+、NO-3、ClO-
C.c(H+)=10-12 mol·L-1的溶液:Na+、S2-、AlO-2、SO2-3
D.使石蕊试液变红的溶液:K+、NH+4、I-、MnO-4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com