
7.有Wn+、Xm+、Ym-、Zn-四种离子(m>n),且W、X、Y、Z四种原子的M电子层上的电子数均为奇数。下列说法中正确的是 ( )
A.Wn+、Xm+、Ym-、Zn-的离子半径依次增大
B.Y、Z的气态氢化物的热稳定性:YHm>HnZ
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强
6.利用下列各组物质制备和收集少量相应气体,能采用下图实验装置的是 ( )
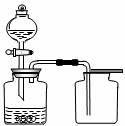
①浓氨水与CaO固体 ②稀盐酸与石灰石 ③稀硝酸和铜片
④过氧化氢溶液与MnO2 ⑤锌粒与稀硫酸 ⑥电石与水
A.①②⑥ B.②④ C.①②③⑥ D.全部
5.某燃料电池所用的原料为H2和空气(含一定量的CO2),电解质为熔融的K2CO3。电池的总反应为:2H2+O2=2 H2O ,负极反应式为:H2+CO32―-2e-=H2O+CO2。下列说法中正确的是 ( )
A.正极反应为:4OH―+4e-=2H2O+O2↑
B.电池工作时,电解质中CO32―的物质的量将减小
|
D.电池工作时,电子从正极经外电路流向负极
4.下列反应的离子方程式正确的是 ( )
A.Cu粉跟浓FeCl3溶液反应:Cu+2Fe3+=Cu2++2Fe2+
B.Na2SiO3溶液中通入过量的CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32-
C.FeBr2溶液中通入足量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D.Na2SO3溶液中加入稀硝酸:SO32-+2H+=SO2↑+H2O
3.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.1molD318O+离子中含有的中子数为10NA
B.1mol SiC晶体中含有的Si-C键数为2 NA
C.44g乙醛与乙酸乙酯的混合物中含有的氢原子数为4 NA
D.22.4L Cl2中含有的分子数为NA
2.下列说法正确的是 ( )
A.H2O、SO2、HClO、Na2O2、O3的漂白原理是相同的
B.乙醇具有还原性,能使酸性KMnO4溶液褪色
C.配制Fe2(SO4)3溶液时,需加入Fe粉和稀硫酸
D.用粗硅制单晶硅(纯硅)的过程中,不涉及氧化还原反应
1.《新科学家》网站报道,科学家通过电解Fe2O3、SiO2、CaO的熔融液(1600℃)制得了铁。若该方法用于工业上冶铁,与常规方法相比,下列说法错误的是 ( )
A.能大幅度降低能耗 B.产生副产品氧气
C.降低温室气体的排放 D.制得更纯的铁
29.某化学小组以苯甲酸为原料制取苯甲酸甲酯,并用制得的苯甲酸甲酯进行碱性水解的实验。
I.制取苯甲酸甲酯
已知有关物质的沸点如下表:
|
物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
|
沸点/℃ |
64.7 |
249 |
199.6 |
实验装置如下:
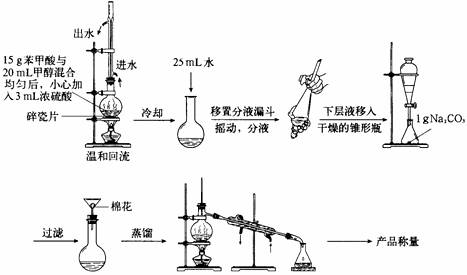
(1)简述第一步混合液体时,最后加入浓硫酸的理由是 。若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式: 。
(2)根据化学计量数之比,反应物甲醇应过量,其理由是 。
(3)分液时上层液体从 出来。
(4)蒸馏所用的玻璃仪器名称为 。接受馏分时温度控制在 。
(5)此制取过程比教材中乙酸乙酯的制备复杂很多,写出用此过程制备苯甲酸甲酯的两大优点: 、 。
II.苯甲酸甲酯碱性水解
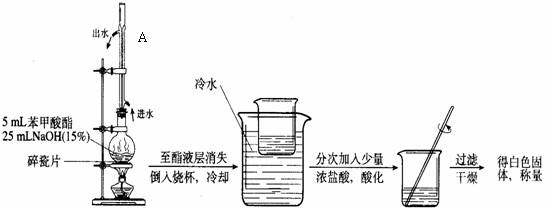
(6)写出苯甲酸甲酯碱性水解的化学反应方程式 。
(7)写出苯甲酸甲酯碱性水解实验装置中A的作用 。
III.苯甲酸甲酯有多种同分异构
(8)符合下列条件的结构
①可以发生银镜反应 ②属于芳香族化合物
③不具备其它环状结构 ④不能与FeCl3发生显色反应
共有 种,请写出其中两种的结构简式: 、 。
28.在世纪交际之时,罗马尼亚国炼金废水泄入尼罗河,导致大量鱼类等水生物死亡,酿成世界级污染事件。沿河居民长期停止使用此水源。已知炼金废水中含有络离子[Au(CN)2]-,其电离出的CN- 有毒,当CN- 与H+ 结合时可生成易挥发性的剧毒物质HCN。回答下列问题:
(1)HCN的结构式为 ,其水溶液酸性很弱,可知NaCN溶液pH 7(填>、=、<)。
(2)与弱电解质H2CO3的电离相似,[Au(CN)2]- 也存在着两步电离,则第一步电离方程式为 。
(3)处理这种废水是在碱性条件下用NaClO将CN- 氧化为CO32- 和N2,其离子方程式为 ,在酸性条件下,ClO- 也能将CN- 氧化,但实际操作时却不在酸性条件下进行,原因是 。
27.I.用仪器A、B和胶管组成装置收集NO气体(①仪器A已经气密性检查;②除水外不能选用其他试剂)。
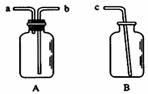
(1)正确的操作步骤是:
II.测定硫酸铜晶体(CuSO4·5H2O)里结晶水的含量,实验步骤为:①研磨 ②称量空坩埚和装有试样的坩埚的质量 ③加热 ④冷却 ⑤称量 ⑥重复③至⑤的操作,直到连续两次称量的质量差不超过0.1g为止 ⑦根据实验数据计算硫酸铜结晶水的含量。
请回答下列问题:
(2)现有坩埚、坩埚钳、三脚架、泥三角、玻璃棒、干燥器、药匙、硫酸铜晶体样品等实验用品,进行该实验时,缺少的实验用品是 。
(3)该实验中哪一步骤需要使用干燥器?使用干燥器的目的是什么?
答: 。
(4)实验步骤⑥的目的是 。
(5)若操作正确而实验测得的硫酸铜晶体中结晶水的含量偏低,其原因可能有(填入选项的编号): 。
A.被测样品中含有加热不挥发的杂质
B.被测样品中含有加热易挥发的杂质
C.实验前被测样品已有部分失水
D.加热前所用的坩埚未完全干燥
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com