
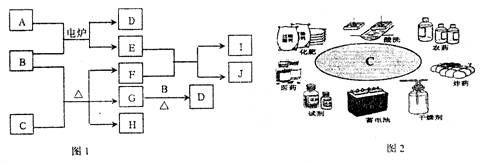
27.(14分)A~I为常见物质,其组成元素的原子序数均不超过20。它们之间的相互转化关系如图1所示,其中B为单质,其他物质均为化合物。C的用途如图2所示,D、G、H、I在常温下均为气体,D与I为可燃性气体且分子中电子数相等,J在工业上可以制取漂白粉。
请按要求填空:
(1)写出下列物质的化学式(分子式):C ,G 。
(2)写出E和F反应的化学方程式:
(3)I的电子式为 。
(4)请再列举一种与D含有相同电子数的单质的化学式 ,它属于 晶体。
(5)J在工业上制取漂白粉的化学方程式是 。
26.(14分)U、V、W、X、Y为短周期元素,且原子半径依次增大,U、V同主族,V、W、X、Y处于同周期,U的最高价氧化物所对应的水化物与其气态氢化物反应生成盐A,U、W、Y的最高价氧化物对应的水化物能互相反应生成盐,Z为血红蛋白中所必需的金属元素,且U、W、Z分别能与氧元素形成U2O3、W2O3、Z2O3 。
回答下列问题:
(1)U的气态氢化物的分子构型为 。盐A中阳离子的检验方法是 。
(2)1mol V的最高价氧化物对应的水化物与3 mol氢氧化钾恰好完全反应,其产物的化学式为 。
(3)W的单质与Y的最高价氧化物对应的水化物的溶液反应,其离子方程式是
(4)0.1 mol U单质与足量的X单质反应,转移的电子为 mol。
(5)Z单质与水在一定条件下反应的化学方程式为 。
13.4g Cu2 S和CuS的混合物在酸性溶液中与150 mL 0.40 moL/L KMnO4溶液恰好完全反应,离子方程式如下:
2MnO4-+Cu2S+8H+=2Cu2++SO42-+2Mn2++4H2O
MnO4-+CuS+H+→Cu2++SO42-+Mn2++H2O(未配平)
则混合物中Cu2S的质量分数为 ( )
A.40% B.50% C.60% D.70%
12.常温时,以下4种溶液pH最小的是 ( )
A.0.01 mol/L-1甲酸溶液
B.0.02 mol/L-1甲酸溶液与0.02 mol/L-1 KOH溶液等体积混合后所得的溶液
C.0.03 mol/L-1甲酸溶液与pH=12的NaOH溶液等体积混合后所得的溶液
D.pH=2的硫酸与0.01 mol/L-1的NaOH溶液等体积混合后所得的溶液
11.如下图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是 ( )
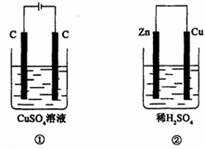
A.产生气体的体积:①>②
B.溶液的pH变化:①增大,②不变
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极2 Cl-一2e-=C12↑,②中负极2H++2e-=H2↑
10.某有机化合物A的相对分子质量大于100,小于130。经分析得知,其中碳和氢的质量分数之和为46.66%,其余为氧,则该化合物分子中最多含碳氧双键的个数为 ( )
A.1 B.2 C. 3 D.4
9.下列叙述正确的是 ( )
A.离子晶体一定含有离子键,分子晶体一定含有共价键
B.某晶体中若含有阳离子,则一定含有阴离子
C.同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
D.同一周期元素的原子,半径越小,越容易得到电子
8.对于可逆反应:mA(g)+nB(g) xC(g);△H=Q在不同温度及压强(P1,P2)条件下,反应物A的转化率如图所示,下列判断正确的是 ( )
xC(g);△H=Q在不同温度及压强(P1,P2)条件下,反应物A的转化率如图所示,下列判断正确的是 ( )
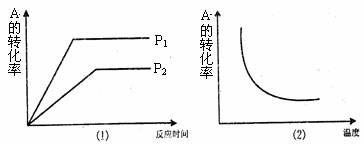
A.Q<O,m+n<x B.Q<O,m+n> x
C.Q>O,m+ n > x D.Q>O,m+ n<x
7.下列反应的离子方程式正确的是 ( )
A.氯气溶于水中:C12+H2 O=2H++Cl一+ClO一
B.向Ba(OH)2溶液中逐滴加入NaHSO4溶液至中性
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.Na2CO3水解:CO32-+2H2O=H2CO3+2OH-
D.NH4HCO3与足量NaOH溶液共热:NH4++OH-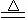 H2O+NH3↑
H2O+NH3↑
6.三聚氰胺是一种以尿素为原料生产的氮杂环有机化合物,常被不法商人用作食品添加剂,以提升食品检测中的蛋白质含量,因此三聚氰胺也被人称为“蛋白精”,它的结构简式如图所示,则下列说法中不正确的是 ( )
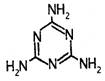
A.三聚氰胺的分子式为C3N6H6 B.三聚氰胺的含氮量比蛋白质的含氮量高
C.三聚氰胺不属于芳香烃 D.三聚氰胺有剧毒,食用少量即可致人死亡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com