
17.在一定条件下密闭容器中的反应:2A(g)+B(g) 2C(g),△H<0到达平衡后,改变一个条件x,下列量y的变化一定符合图中曲线的是
2C(g),△H<0到达平衡后,改变一个条件x,下列量y的变化一定符合图中曲线的是
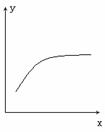
|
|
x |
y |
|
A |
再加入A |
B的转化率 |
|
B |
再加入C |
A的体积分数 |
|
C |
缩小体积 |
A的转化率 |
|
D |
升高温度 |
混合气体的平均摩尔质量 |
16.下列叙述不正确的是
A.金刚砂的成分是Al2O3,可用作砂纸、砂轮的磨料
B.水晶和玛瑙的主要成分都是SiO2
C.含硅的钢具有良好的导磁性
D.利于环保、节能的太阳能电池可用硅材料制作
15.下列实验操作完全正确的是
A.配制100 mL 0.1 mol·L-1的NaCl溶液时,先量取10 mL 1 mol·L-1的NaCl溶液倒入容量瓶中,再加水稀释至刻度线
B.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度
C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
D.乙醇与金属钠的反应,在盛有少量乙醇溶液的试管中,加入一小块新切的、用滤纸擦干表面煤油的金属钠
14.下列各溶液中,叙述正确的是
A.0.1mol/L的(NH4)2SO4溶液中: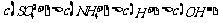
B.25℃时,将pH=3的盐酸溶液和pH=11的氨水等体积混合后,溶液中离子浓度的关系: 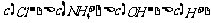
C.将0.1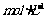 醋酸溶液加大量水稀释后,溶液的pH增大
醋酸溶液加大量水稀释后,溶液的pH增大
D.Na2CO3溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
13.室温下,某溶液中由水电离出的H+和OH-物质的量浓度乘积为1×10-28,该溶液中一定不能大量共存的是
A.Cl-、AlO2-、K+、Na+ B.Fe2+、NO3-、Ba2+、Cl-
C.Fe3+、SO42-、MnO4-、Na+ D.Na+、K+、CO32-、SO42-
12.下列离子方程式书写正确的是
A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中
Ca2++2HCO +2OH-=CaCO3↓+2H2O+CO
+2OH-=CaCO3↓+2H2O+CO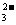
B.用石墨作电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C.向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
D.向氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
11.铜的冶炼大致可分为:
①富集,将硫化物矿进行浮选;
②焙烧,主要反应为:2CuFeS2+4O2==Cu2S+3SO2+2 FeO(炉渣);
③制粗铜,在1200℃发生的主要反应为:
2Cu2S+3O2 ==2Cu2O+2SO2 ;2Cu2O+ Cu2S==6 Cu+SO2↑;
④电解精炼铜。
下列说法正确的是
A.上述灼烧过程的尾气均可直接排空
B.上述过程中,由6mol CuFeS2制取6molCu时共消耗12 molO2
C.在反应2Cu2O+ Cu2S == 6 Cu+SO2↑中,只有Cu2O作氧化剂
D.电解精炼铜时,粗铜应与外接电源的正极相连接
10.X+、Y+、M2+、N2-均为含若干电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+>X+、Y+>M2+、M2+>X+。下列比较中正确的是
A.原子半径:N可能比Y大,也可能比Y小
B.M2+、N2-核外电子数:可能相等,也可能不等
C.原子序数:N>M>X>Y
D.碱性:M(OH)2>YOH
9.某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是:①有固体析出 ②c[Ca(OH)2]增大 ③pH不变 ④c(H+)c(OH-)的积不变 ⑤c(H+)一定增大
A.① B.①③ C.①②④ D.①⑤
8.现有常温下的四份溶液:
①0.01mol·L-1CH3COOH;②0.01mol·L-1HC1;③pH=12的氨水;④pH=12的NaOH溶液。
下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若pH=7,则消耗溶液的体积:②=③
C.将四份溶液稀释相同倍数后,溶液的pH:③>④;②>①
D.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com