
27.(8分)写出往硫酸铜溶液中逐滴加入氨水的化学反应现象和含铜最终生成物的化学式:_____________________________,____________________。
26.(10分)(1)25℃,101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式是____________________。
(2)同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-akJ·mol-1
P(红磷,s)+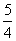 O2(g)=
O2(g)=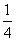 P4O10(s) △H=-bkJ·mol-1
P4O10(s) △H=-bkJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
24.下列叙述中正确的是 ( )
A.需要加热方能发生的反应不一定是吸热反应
B.在101kPa时1mol物质燃烧时的反应热叫做该物质的标准燃烧热
C.如果反应物所具有的总能量大于生成物所具有的总能量,则发生的反应是吸热反应
D.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应。25.已知25℃.101kPa下,石墨、金刚石燃烧的热化学方程式分别为:
C(s,石墨) + O2(g)=CO2(g);△H=-393.51kJ ·mol-1
C(s,金刚石) + O2(g)= CO2(g);△H=-395.41kJ ·mol-1
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高
23.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是 ( )
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
22.(19分)下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。
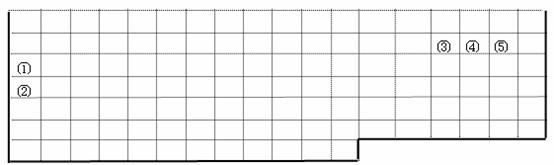
⑴请在上表中用实线补全元素周期表上边界。
⑵元素⑤的原子核外p电子数比s电子总数多 个,元素⑤的原子结构示意图为 。
⑶元素④-般在化合物中显____价,但与___形成化合物时,所显示的价态则恰好相反。
⑷在元素①的单质.元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是__ ___。
A.元素①的单质 B.元素②的单质
C.元素①②形成的合金 D.无法判断
第Ⅱ卷(共50分)
21.(21分)
(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式),该物质在CCl4中的溶解度比在水中的溶解度_______ (填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
|
代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
A |
邻-硝基苯酚 |
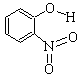 |
0.2 |
45 |
100 |
|
B |
对-硝基苯酚 |
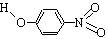 |
1.7 |
114 |
295 |
(3)晶格能的大小:MgO_________NaCl,键能的大小:HBr_______HI。(填“>”、“=”或“<”= )
20.有关乙烯分子中的化学键描述正确的是 ( )
A.每个碳原子的sp2杂化轨道中的其中一个形成π键
B.每个碳原子的未参加杂化的2p轨道形成σ键
C.碳原子的三个sp2杂化轨道与其它原子形成三个σ键
D.碳原子的未参加杂化的2p轨道与其它原子形成σ键
19.以极性键结合的多原子分子,分子是否有极性取决于分子的空间构型。下列分子属极性分子的是 ( )
A.H2O B.CO2 C.BCl3 D.CH4
18.用价层电子对互斥理论预测H2O和BF3的立体结构,两个结论都正确的是 ( )
A.直线形;三角锥形 B.V形;三角锥形
C.直线形;平面三角形 D.V形;平面三角形
17.在元素周期表中,原子最外电子层只有2个电子的元素是 ( )
A.一定是金属元素 B.一定是稀有气体元素
C.一定是过渡元素 D.无法判断是哪一类元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com