
13.将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下,发生反应:2SO2(g)+ O2(g) 2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5molO2和0.5mol SO2,则重新达到平衡后,SO3的物质的量为下列的 ( )
2SO3(g)。反应达到平衡时SO3为0.3 mol。若此时移走0.5molO2和0.5mol SO2,则重新达到平衡后,SO3的物质的量为下列的 ( )
A.等于0.3mol B.等于0.15mol
C.小于0.15mol D.大于0.15mol,小于0.3mol
第Ⅱ卷(非选择题)
12.根据相关化学原理分析,下列推断正确的是 ( )
A.若X的质子数为a,中子数为b,则X的质量数为:a-b
B.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性比较为:NaA的<NaB的
C.若R2-和M+的电子层结构相同,则原子序数的比较为:R的>M的
D.若有反应A2+2D- 2A-+D2,则氧化性的比较为:D2的>A2的
2A-+D2,则氧化性的比较为:D2的>A2的
11.①pH=0的盐酸 ②0.5mol·L-1盐酸 ③0.1 mol·L-1的NH4Cl溶液
④0.1 mol·L-1的NaOH溶液 ⑤0.5 mol·L-1的NH4Cl溶液
以上溶液中水电离的c(H+)由大到小的顺序是 ( )
A.⑤③④②① B.①②③⑤④ C.①②③④⑤ D.⑤③④①②
10.下列溶液中离子浓度关系表示正确的是 ( )
A.NaHCO3溶液中:c(H+) + c(Na+)=c(OH-)+ c(CO32-)+ c(HCO3-)
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)<c(OH-)
C.0.1mol/L的NH4Cl溶液中,c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:
2c(Na+)=c(CH3COOH)+ c(CH3COO-)
9.下列各组物质中,气体X和气体Y在通常条件下同时通入盛有溶液Z的洗气瓶中(如图所示),一定没有沉淀生成的是 ( )
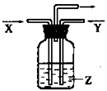
|
|
X |
Y |
Z |
|
A |
NO2 |
SO2 |
BaCl2 |
|
B |
NH3 |
O2 |
Al2(SO4)3 |
|
C |
NH3 |
CO2 |
NaCl(饱和) |
|
D |
CO |
O2 |
Ca(OH)2 |
8.用NA表示阿伏伽德罗常数的值。下列叙述正确的是 ( )
A.1mol Cl2发生反应时,转移的电子数一定是2NA
B.标准状况下,2.24L己烷中含有的非极性键数为0.5NA
C.1L 1mol·L-1的FeCl3溶液中含有铁离子的数目为NA
D.常温常压下,4.4g CO2和N2O混合物中所含有的原子数为0.3NA
7.化学与生活、社会密切相关。下列说法正确的是 ( )
A.臭氧能对水体消毒,是因为其能杀死水中的病菌
B.执行“限塑令”主要是为了节约能源
C.含磷洗涤剂因为其易被细菌分解,所以不会导致水体污染
D.新装修的住房中放置任何花卉都能降低居室中甲醛含量
31.硫化钠是用于皮革鞣质的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:
①Na2SO4+4C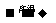 Na2S+4CO
Na2S+4CO
②Na2SO4+4CO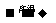 Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.8克,需要无水芒硝(Na2SO4) g;
(2)若在反应中生成Na2S的物质的量为1 mol,则消耗的碳单质的物质的量n的范围是 <n< ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= 。
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4,现称取已经被部分氧化的硫化钠39.2g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况),求:39.2g被部分氧化的硫化钠中Na2SO4的物质的量。(要求写出计算过程)
30.将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如下图所示:
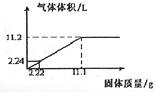
(1)硫酸物质的量浓度是 mol·L-1。
(2)当硫酸溶液为350mL,固体粉末为33.3g时,充分反应后产生的气体体积为 L(标准状况下)
(3)原固体混合物Mg和Al的物质的量之比为 。
29.利用芳香烃和链烃Y可以合成紫外线吸收剂BAD,BAD的结构简式为:
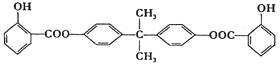
BAD的合成路线如下(已知G不能发生银镜反应)
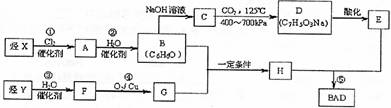
试回答下列问题:
(1)写出结构简式:Y ;D 。
(2)属于取代反应的有 (填数字序号)。
(3)1molBAD最多可含 mol NaOH的溶液完全反应。
(4)写出下列反应的化学方程式:
反应④: ;
B+G→H: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com