
10.在给定条件下,下列加点的物质在化学反应中能被完全消耗的是 ( )
A.用50mL8 mol·L-1 浓盐酸与10g二氧化锰共热制取氯气
B.标准状况下,将1g铝片投入20mLl8mol·L-1的硫酸中
C.向100mL3 mol·L-1的硝酸中加入5.6g铁
D.在5×107Pa、500 ℃和铁触媒催化的条件下,用氮气和氢气合成氨
9.一定能在下列溶液中大量共存的离子组是 ( )
A.pH=1的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13mol/L的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.滴入酚酞显红色的溶液:Na+、K+、AlO2-、CO32-
8.关于元素周期表的下列说法中正确的是 ( )
A.同一短周期元素,核电荷数越大,其单质的还原性越弱
B.第n主族的元素,其最高化合价一定为+n价
C.同主族元素的气态氢化物,相对分子质量越大,沸点越高
D.同主族元素,原子半径越大,其单质的熔点越高
7.设NA为阿伏伽德罗常数,下列叙述正确的是 ( )
A.2.24LCO2气体中含有的原子数为0.3NA
B.25℃时,pH=13的烧碱溶液中约含0.1NA个OH-
C.1L 1mol/L的醋酸溶液中所含离子总数为2NA
D.常温常压下,16g氧气与臭气的混合气体中所含的原子数为NA
6.下列各组归类正确的是 ( )
A.同位素:1H、D+、T2
B.电解质:H2O、CH3COOH、NH4HCO3
C.非极性分子:C60、CO2、CH2、Cl2
D.同系物: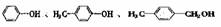
24.(7分)下表的实线表示元素周期表的部分边界,①-⑥分别表示元素周期表中对应位置的元素。
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
① |
② |
③ |
④ |
|
|
⑤ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在上表中用实线补全元素周期表边界
(2)元素②的氢化物电子式为: 。
(3)元素④的氢化物在CCl4中溶解度比在水中的溶解度 (填“大”或“小”)。
(4)元素⑤的单质,元素⑥的单质和⑤⑥形成的合金,这三种物质中,熔点最低的是 。
A.元素⑤的单质 B.元素⑥的单质
C.⑤⑥形成的合金 D.无法判断
(5)由元素①的最简单的氢化物,元素③的单质和KOH溶液组成的新型燃料电池中,负极上发生的反应的电极反应式为: 。
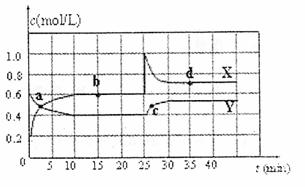
23.(8分)可知NO2和N2O4可以相互转化:2NO2(g)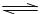 N2O4(g);△H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图。
N2O4(g);△H<0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图。
回答下列问题:
(1)图象中的平衡点是: (用a、b、c、d填空)。
(2)图中的两条曲线, 是表示N2O4浓度随时间的变化曲线(填“X”或“Y”)。
(3)前10 min内用υ(NO2)表示的化学反速率为 。
(4)25 min时,导致平衡移动的原因是 。
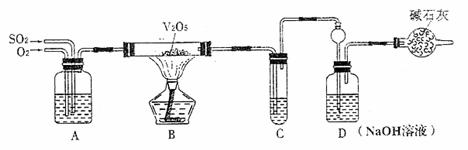
22.(8分)某校活动小组用下图所示装置及所给药品(图中夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知C中的浓硫酸含溶质m mol,假设气体进入C和D时分别被完全吸收,且忽略装置内空气中的CO2。
请回答下列问题:
(1)已知0.5 molSO2被O2氧化成气态SO3,放出49.15kJ热量,反应的热化学方程式为 。
(2)实验时A中氧气导管冒出的气泡与二氧化硫导管冒出的气泡速率相近,其目的是 ;装置C中浓硫酸的作用为 。
(3)停止通入SO2,熄灭酒精后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是 。
(4)实验结束后,稀释装置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀质量为ωg。若装置D增加的质量为a g,则此条件下二氧化硫的转化率是_________(用含字母的代数表示,结果可不化简)。
21.(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合后所得溶液的pH如下表:
|
实验编号 |
HA的浓度/(mol·L-1) |
NaOH的浓度/(mol·L-1) |
混合溶液的pH |
|
甲 |
0.2 |
0.2 |
pH=a |
|
乙 |
c |
0.2 |
pH=7 |
|
丙 |
0.1 |
0.1 |
pH>1 |
请回答:
(1)不考虑其他组的实验结果,仅从甲组情况分析,如何用a的大小来说明HA是强酸还是弱酸 。
(2)不考虑其他组的实验结果,仅从乙组情况分析,c是否一定等于0.2 (填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是 (填序号)。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是 。
20.(9分)下图所涉及的物质均为中学化学中常见的物质,其中C、D为气体单质,E为常见金属单质,其余为化合物,F晶体具有磁性,它们之间存在如下转化关系(部分产物已省略)。
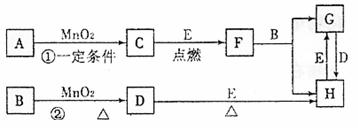
请回答下列问题:
(1)若反应①是在加热条件下进行的,则A是(填化学式) ;若反应①是在常温条件下进行的,则A是(填化学式) ;若在上述两种条件下得到等量的C单质,反应中转移的电子数之比为 。
(2)写出②的离子反应方程式: 。
(3)H用途广泛,如用作催化剂,印刷电路腐蚀剂和外伤止血剂及净水等。若将Cu棒与碳棒用导线连接并插入H溶液中,可形成原电池,其中正极电极反应方程式为:
。
(4)写出G与D反应生成H的化学方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com