
11.2008年9月16日国家质检总局在22家企业69批次产品中检出了含量不同的三聚氰胺,其结构如下图所示。有关该化合物的说法不正确的是( )
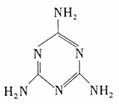
A.分子中含有苯环结构
B.1mol三聚氰胺能和3mol H2发生加成反应
C.分子式为C3N6H6
D.氮元素的质量分数为2/3
10.下列离子方程式书写正确的是 ( )
A.NH4HCO3溶液与过量的NaOH溶液共热:NH4++OH-=NH3↑+H2O
B.FeSO4溶液中(已酸化)滴加双氧水:Fe2++2H2O+4H+=Fe3++4H2O
C.Al粉与NaOH溶液反应:Al +2OH-=AlO-2+H2↑
D.在澄清的石灰水中通入过量的CO2:CO2+OH-=HCO-3
9.下列叙述正确的是 ( )
A.同一主族的两种元素的原子序数之差可能为16
B.同一主族元素的最高价氧化物形成的晶体,结构和类型一定相同
C.同一短周期元素的离子半径从左到右一定增大
D.离子化合物的熔点一定比共价化合物的熔点高
8.下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此,下列说法正确的是 ( )

A.该硫酸的物质的量浓度为9.2 mol·L-1
B.该硫酸与等体积的水混合所得溶液的质量分数小于49%
C.配制200mL 4.6 mol·L-1的稀硫酸需取该硫酸50.0mL
D.该硫酸50.0mL与足量的铜反应可得到标准状况下SO2气体10.304L
7.有三种说法:①NH4NO3中氮元素只显+5价;②2FeS2+11O2=2Fe2O3+8SO2反应中+2价铁和-价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等。这三种说法中错误的是 ( )
A.只有① B.只有②③ C.只有①③ D.①②③
6.与当今地球上重大环境问题不相关的物质是 ( )
A.CO2 B.N2 C.SO2 D.CCl2F2(氟利昂)
29.(15分)ABCDE分别属于元素周期表中前20号元素,其原子序数依次递增,并且其中只有一种金属元素。A原子是元素周期表所有元素原子半径最小的;B和C原子都只有两个电子层,B原子中一层电子数是另一层的两倍;C原子中两层电子数之和是两层电子数之差的两倍;D原子中某一层电子数是另外两层电子数之和;E的阳离子和D的阴离子具有相同的电子层结构且所带电荷数相等。请按要求回答下列问题:
(1)画出E的离子结构示意图 ,写出由A和C组成的含有非极性键的化合物的电子式 ;
(2)由上述元素组成的化合物中属于极性健构成的非极性分子是(只要求写出两种,用化学式表示) , ;
(3)由C与E形成的化合物高温时与B形成的物质反应生成两种化合物,请写出该反应的化学方程式: 。
(4)写出上述元素形成的化合物中一种可溶性的正盐与另一种强酸反应的离子方程式:
。
(5)上述元素形成的化合物中通常能污染空气的气体有(只要求写出两种,用化学式表示) , ;
某一种可污染空气的化合物与强氧化剂单质在一定条件下反应能生成两种化合物,该反应的化学方程式为: 。
28.(18分)根据下述实验装置和操作,回答有关问题。
(1)按图中所示装置,用两种不同操作分别进行实验,观察B管中现象。
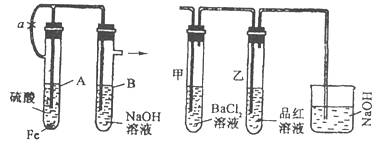
操作1:先夹紧止水夹a,再使A管开始反应,实验中在B管中观察到的现象是 。
操作2:打开止水夹a,使A管开始反应一段时间后再来夹紧止水夹a。实验中在B管中观察到的现象是: ;
B管中发生反应的化学方程式是: , 。
(2)上述装置的实验结束后,取A管内反应所得溶液,隔绝空气小心蒸干后再高温煅烧(有关装置及操作均已略去),最后留下红色固体,将分解时产生的气体按图所示装置依次通过洗气装置,结果试管甲内出现白色沉淀,试管乙内溶液红色褪去,回答:
问题1:用化学方程式说明试管甲产生白色沉淀的原因(不用文字说明)。
, 。
问题2:根据实验现象,写出图中A管内溶液蒸干后,在高温煅烧分解时所产生的氧化还原反应的化学方程式
这个反应的氧化剂是 ,还原剂是 。(用化学式表示)
27.(14分)
(1)配平氧化还原反应方程式:
C2O42-+ MnO4-+ H+=== CO2+ Mn2++ H2O
(2)称取6.0g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液到20mL时,溶液由于无色变为浅红色(全部中和为正盐)。该溶液被中和的H+的物质的量为 mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸酸钾溶液至16mL时反应完全,此时溶液颜色由 变为 。该溶液中还原剂的物质的量为 mol。
③原试样为H2C2O4·2H2O的质量分数为 。KHC2O4的质量分数为 。
26.(13分)A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还含有元素X、Z,元素X、Y、Z的原子序数依次递。又知
①Y元素在A、B、C、D、E中所呈现化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应生成C和E;
③工业上以A、空气、水为原料通过催化氧化法制取E。请回答以下问题:
(1)A分子的空间构型是 ;B分子的电子式为 。
(2)写出②中发生的反应的化学方程式 。
(3)由B制取1molA放出46.2kJ的热量,试写出该反应的热化学方程式:
(4)若在1L的密闭容器中加入催化剂和0.8mol的A,加热并控制一定温度,2min时达到平衡,经测定此时A的物质的量的浓度为0.42mol·L-1,则反应开始至达到平衡时,用v(A)表示的平均速率为 mol·L-1·min-1;平衡时容器内气体的物质的量是起始时的 倍。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com