
5.分别将下列物质 ①CuSO4 ②Na2O2 ③Na2CO3 ④NH4Cl ⑤FeCl3投入水中,并对其溶液加热蒸干和灼烧,仍能得到原物质的是
A.①②③ B.③⑤ C.①③ D.④⑤
4.在一固定体积的密闭容器中,加入2molA和1molB,发生反应如下;
2A(气)+B(气)
 3C(气)
+ D(气),当反应达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L的是
3C(气)
+ D(气),当反应达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种配比作为起始物质,达平衡后,C的浓度仍为Wmol/L的是
A.4molA+2molB B.3molC + 1molD
C.3molA +1molB +1molC D.1.5molC + 0.5molD
3.25℃时,若pH = a的10体积某强酸溶液与pH = b的1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系
A.a+b=14 B.a+b=13 C.a+b=15 D.a+b=7
2.为了使(NH4)2SO4溶液中c(NH4+)和c(SO42-)之比更接近2∶1,可向溶液中加入少量
A.硫酸 B.盐酸 C.氢氧化钠溶液 D.氯化钠溶液
1.下列条件一定能使反应速率加快的是:①增加反应物的物质的量②升高温度③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2
A.全部 B.①②⑤ C.② D.②③
21.选做题 本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”二个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答,将按A题评分。
A.(12分)下表为长式周期表的一部分,其中的编号代表对应的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
⑦ |
|
|
|
⑧ |
|
|
|
|
|
|
|
⑨ |
|
|
⑩ |
|
|
|
|
|
|
|
|
|
试填空。
(1)写出上表中元素⑨原子的外围电子排布式 。
(2)元素③与⑧形成的化合物中元素③的杂化方式为: 杂化,其形成的化合物的晶体类型是:______________ _ _。
(3)元素④、⑤的第一电离能大小顺序是: > (用元素符号表示);元素④与元素①形成的X分子的空间构型为: 。请写出与N3-互为等电子体的分子、离子的化学式 , (各写一种)。
(4)在测定①与⑥形成的化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是: 。
(5)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质,写出元素②的氢氧化物与NaOH溶液反应后盐的化学式 。
(6)元素⑩在一定条件下形成的晶体的基本结构单元如下图1和图2所示,则在图1和图2的结构中与该元素一个原子等距离且最近的原子数之比为: 。

B.(12分)浓硝酸广泛应用于有机合成、医药、有色金属冶炼和原子能工业。工业产量仅次于硫酸,在各类酸中居第二位。用铝罐车运输浓硝酸时,会在出入口处出现腐蚀现象。某化学实验小组对此进行了研究。经查阅资料获如下信息:
|
HNO3的浓度 |
与铝发生的主要化学反应 |
|
8 mol·L–1左右 |
Al + 6HNO3 = Al(NO3 )3 + 3NO2 ↑+ 3H2O |
|
介于3~4mol·L–1 |
15Al + 56HNO3 = 15Al (NO3 )3 + NH4NO3 +NO2
↑+ 2NO ↑+ 3N2 ↑+ 26H2O |
|
介于1~3mol·L–1 |
8Al + 30HNO3 = 8Al ( NO3 )3 + N H4NO3
+NO2 ↑+ NO ↑+ N2 ↑+ H2 ↑+ 12H2O |
|
小于1mol·L–1 |
14Al + 46HNO3 = 14Al( NO3 )3 + 2N2 ↑ +11H2
↑+ 12H2O |
实验步骤如下(装置见下图):
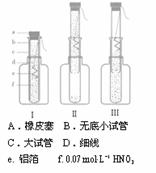
①取1 支与大试管等长的无底小试管套入大试管内,将
|
②取一块铝箔系在细线的一端后,浸入NaOH溶液中,见表面产生气泡时,取出铝箔用水冲洗掉碱液。然后将铝箔再浸入HgCl2 溶液中,见表面呈现灰黑色(约1 min) 时,取出并将其放入上述准备好的小试管中,立即塞上橡皮塞,如图Ⅰ所示。
③迅速提起小试管,使其下端略低于大试管口,用试管夹将其夹住搁在大试管口上,如图Ⅱ所示。试填空。
(1)广口瓶的作用是:______;配制0.07 mol·L–1 HNO3所需带刻度的仪器有______。
(2)写出实验步骤②中发生的主要反应的化学方程式 ;
并解释其作用是:________ ____。
(3)为了验证实验所产生的主要气体为H2,在图Ⅲ的装置上进行操作,具体方法为:
_________ 。
(4)事实表明,在用铝罐车运输浓硝酸或浓硫酸时,发现一定时间后,在酸的出入口处皆会出现腐蚀现象,综合所学知识分别给予解释。
20.(8分)某实验人员做了下列实验:将适量1.00 mol·L―1 CuSO4溶液和2.00 mol·L―1NaOH溶液混合,得到一种浅绿色碱式盐沉淀A[aCu(OH)2·bCuSO4]。将9.08g A隔绝空气在1000℃以上强热,得到了5.76g红色固体B,同时得到x mol的混合气体;再将5.76g B溶于稀硫酸得到2.56g另一种红色固体C(已知:铜的化合价有+1和+2价)。
(1)B与稀硫酸反应的离子方程式为: 。
(2)通过计算确定A的组成。
(3)x的取值范围是: 。
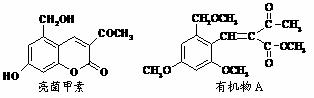
19.(10分)利胆解痉药“亮菌甲素”跟(CH3)2SO4反应可以生成A,二者的结构简式如图。
试填空。
(1)“亮菌甲素”的分子式为: ,1mol“亮菌甲素”跟浓溴水反应时最多消耗______mol Br2;
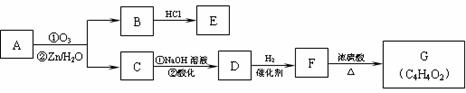
(2)有机物A能发生如下转化,其中G分子中的碳原子在一条直线上。
信息提示:i.
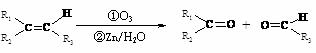
ii.R―O―CH3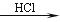 R―OH(R为脂肪烃或芳香烃的烃基)
R―OH(R为脂肪烃或芳香烃的烃基)
①C→D的化学方程式是: 。
②G的结构简式是: 。
③同时符合下列条件的E的同分异构体有 种。
A.遇FeCl3溶液显色;
B.不能发生水解反应,能发生银镜反应;
C.苯环上的一氯取代物只有一种,分子中无甲基。
写出其中任意一种的结构简式: 。
18.(12分)汽车或飞机行驶速度越高,单位时间内燃料燃烧速度越快,产生温度越高,越可能达到N2与O2反应的条件,生成NO在空气中部分被氧化成NO2。我们用NOx来表示空气中氮氧化物的x值与地球表面距离h的关系如图所示。
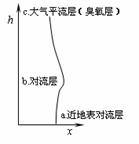
(1)关于x与h关系的解释主要是光化学原理。
已知:O2(g)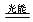 2O(g) ΔH=a kJ·mol―1;
2O(g) ΔH=a kJ·mol―1;
NO2(g)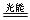 NO(g)+O (g) ΔH=b kJ·mol―1;
NO(g)+O (g) ΔH=b kJ·mol―1;
则2NO(g) + O2 (g) = 2NO2 (g) ΔH= kJ·mol―1。
(2)空气中的NOx的组成可以表示为:
f (x) =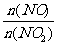 =
。
=
。
(3)NOx对平流层O3浓度减少,形成臭氧空洞的机理可以用如下图示解释:
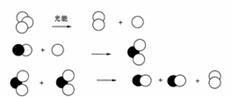
则平流层臭氧浓度减小的总反应化学方程式为: 。
(4)在2 L密闭容器中反应2NO2(g) 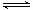 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L―1)随时间(min)的变化如图所示(不考虑生成N2O4)。试填空。
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L―1)随时间(min)的变化如图所示(不考虑生成N2O4)。试填空。
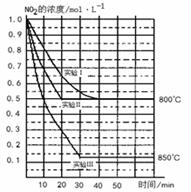
① 对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是: 。(填字母)
A.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
B.实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容器的体积缩小了
C.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效率更高的催化剂
D.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反应的平衡常数
② 若实验Ⅰ中达平衡后,再向密闭容器中通入1 mol由物质的量之比为1︰1组成的NO2与NO混合气体(保持温度不变),则平衡将 移动,新条件平衡状态时NO2的物质的量浓度为: mol·L―1。
17.(11分)某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程:
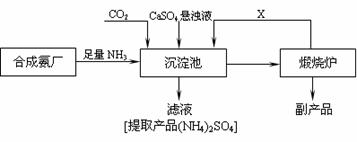
试填空。
(1)沉淀池中发生主要反应的化学方程式为:_______________________ ,该反应能够发生的原因是:______________________________________。
(2)提纯滤液以获得(NH4)2SO4晶体,必要的操作步骤是:____________(填序号)。
A.萃取 B.蒸发浓缩 C.冷却结晶 D.蒸馏
(3)该生产过程中可以循环使用的物质X是:_____________________(填化学式)。
(4)上述生产流程中,有关NH3的作用及说明正确的是:_____________(填序号)。
A.提供制备所需的氮元素 B.增大CO32-的浓度促进反应发生
C.作反应的催化剂 D.生产1 mol (NH4)2SO4,至少消耗2 mol NH3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com