
10.X、Y、Z为三种短周期元素,它们在周期表中的位置如下图所示:有关这三种元素说法一定正确的是 ( )
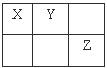
A.原子半径: Z>Y>X
B.Z原子最外层为8电子稳定结构
|
D.若X、Y、Z均有氢化物,则Y的氢化物沸点可能最高
9.下列说法中正确的是 ( )
A.向饱和Na2CO3溶液中通入过量的CO2,溶液中无明显现象
B.将8 g SO3 放入92 g水中,所得溶液溶质质量分数为8 %
C.已知H+(aq) + OH-(aq) = H2O(l);△H = -57.3 kJ/mol。将4 g氢氧化钠固体放入100 mL 1 mol/L的稀盐酸中,放出了5.73 kJ的热量
D.向100 ml 1 mol/L的Ca(HCO3)2 溶液中加入等浓度等体积的NaOH溶液,溶液的碱性减弱
8.下列装置中,a5是铁电极,其余为石墨电极,烧杯中液体体积均为100 mL,放置一段时间后,有关叙述不正确的是(不考虑溶液体积变化) ( )
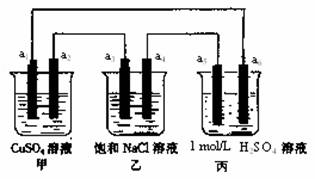
A.a2电极上有亮红色固体
B.a1、a3电极上产生的物质,物质的量比是1:2
C.丙中的SO42-向a6电极移动
D.当装置电路中有6.02×1021个电子通过时,乙中溶液的pH是13
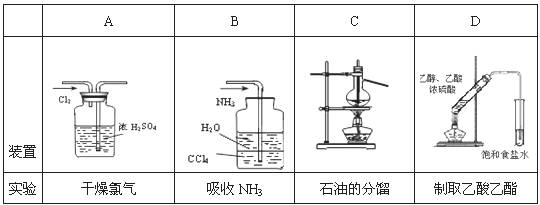
7.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的的是 ( )
6.某无色溶液中只可能含有Na+ 、Ba2 +、 Cl一、 Br一、SO32一、SO42一,对该溶液进行下列实验,实验操作和现象如下表: ( )
|
步骤 |
操 作 |
现 象 |
|
(1) |
取少量溶液滴加几滴石蕊试液 |
溶液变蓝 |
|
(2) |
另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 |
上层无色,下层呈橙红色 |
|
(3) |
取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 |
有白色沉淀产生 |
|
(4) |
向(3)的滤液中加入过量AgNO3溶液和稀HNO3 |
有白色沉淀产生 |
下列结论正确的是 ( )
A.可能含有Cl一、 SO32一、SO42一 B.肯定没有Ba2 +、Cl一、Br一
C.不能确定Na+ 、 SO32一、SO42一 D.肯定有含Na+、 Br一、SO32一
5.燃放烟花爆竹是中国的一种传统。据报道,2009年的元宵节当晚,北京因过渡燃放出现了少有的严重污染的天气。下列有关烟花爆竹说法正确合理的是 ( )
A.绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的化合物
B.燃放烟花爆竹时的主要污染物是CO、CO2 、SO2、烟尘等物质
C.燃放烟花爆竹时只发生了化学变化,没有物理变化
D.为了保证燃放烟花爆竹时的空气质量,应该同时进行人工降雨除掉污染物
21.选做题,共计12分。本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容,每题12分。请选择其中一题作答,若两题都作答,将按A题评分。
A.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
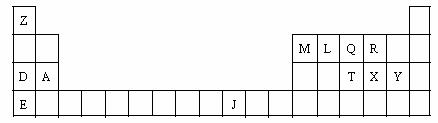
(1)Y分别与D、E形成的化合物中熔点较高的是_________(用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是__________(用元素符号表示)。
(2)LX2分子的电子式是________,XY2分子是_________(填“极性分子”或“非极性分子”);QY3分子中Q采用________杂化。
(3)由J、L、R三种元素形成的某种配位化合物,该化合物具有挥发性,化学式
J(LR)4,其中J的化合价是0价。则J原子的核外电子排布式是_________(基态);与配体粒子互为等电子体的离子是_______;J(LR)4固态时属于______晶体(填晶体类型)。
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多种同分异构体(其中Q以三个单键与其它原子相连),请写出其中沸点最低的物质的结构简式__________。
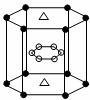
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导温度的最高记录。下图所示的是该化合物的晶体结构单元。图中上下底面中心“△”处的原子是______(填元素符号)。
B.七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用。利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其它杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
|
温度/℃ |
10 |
30 |
40 |
50 |
60 |
|
CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
|
MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
用硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表1和表2数据,回答下列问题:
(1)过滤Ⅰ的滤液中加入硼镁泥,调节溶液的pH=5-6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子方程式为________________。加热煮沸的主要目的是_____________________________。
(2)沉淀B中除MnO2、SiO2外,还含有__________(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是__________________。
(4)沉淀C的化学式是___________。过滤Ⅲ需趁热过滤的理由是_____________。
20.(10分)甲苯与干燥的氯气在光照下反应生成氯化苄(C6H5CH2Cl),用下列方法分析粗产品的纯度:称取0.250g样品,与25mL 4 mol/L的NaOH溶液在100 mL 圆底烧瓶中混合,加热回流,再冷却至室温,加入50 mL 3 mol/L的HNO3溶液后,用25.00mL 0.1000mol/L的AgNO3溶液处理,最后以(NH4)2Fe(SO4)2 为指示剂,用0.1000mol/L的NH4SCN溶液滴定剩余的AgNO3,达到终点时消耗NH4SCN溶液7.50mL。
(已知:①C6H5CH2Cl的相对分子质量为126.5,②Ag++SCN-=AgSCN↓)
(1)写出氯化苄在碱性条件下加热水解的反应方程式____________________________;
(2)计算样品中氯化苄的质量分数;(写出计算过程)___________________
(3)上述方法测定结果往往会高于样品中的氯化苄实际含量,原因是_____________。
19.(12分)某芳香烃的分子式为C12H14,其苯环上的一氯代物只有一种,A能发生如下图所示的转化,并最终制得合成纤维J和合成橡胶K。(某些反应条件已略去)
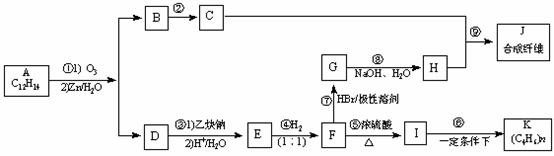
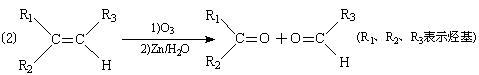
已知: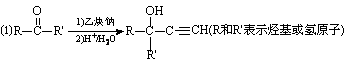

Ⅰ.请回答下列问题:
(1)反应⑤的反应类型是___________,反应⑦的反应类型是________________。
(2)A的结构简式是___________________。
(3)反应⑨的反应方程式是__________________________。
(4)请写出两种符合下列条件的B的同分异构体的结构简式:①能与FeCl3溶液反应显色;②能与溴的CCl4溶液发生加成反应;③苯环上有三个取代基。_________、________。
Ⅱ.3-戊醇可作香料。以甲醛和乙炔钠为原料,其他试剂自选,完成其合成路线。
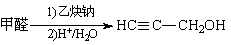 _______________________________。
_______________________________。
18.(10分)随着室内空气污染问题得到越来越多的关注,利用TiO2光催化剂来净化空气的研究已经成为研究的热点。
(1)苯和甲苯是常见的室内挥发性有机污染物。下列物质中也属于室内挥发性有机污染物的是___________________。(填字母)
a.甲醛 b.二甲苯 c.醋酸 d.一氧化碳
(2)下列措施中,有利于降低室内污染物浓度的是__________。(填字母)
a.勤开窗通风 b.日常生活中利用天然气替代煤作燃料
c.使用“绿色环保”装饰材料 d.室内放一些活性碳
(3)文献报道某课题组研究了在不同条件下污染物初始浓度、O2的浓度、催化剂的用量等对TiO2光催化剂催化降解苯和甲苯效率的影响。实验过程中检测得知:密闭容器中,在有氧或无氧条件下,苯的降解产物都是苯酚,甲苯的降解产物都是苯甲酸,其他实验数据如图(图中C/C0表示某时刻污染物浓度与其初始浓度的比值):
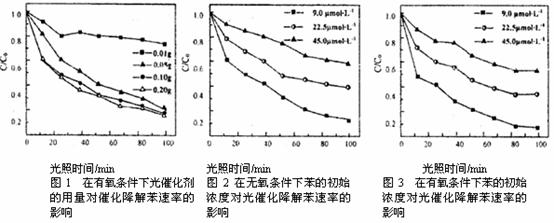
下列相关结论或说法中,不正确的是______________。(填字母)
a.在有氧条件下光催化降解苯,相同条件下光催化剂最佳使用量为0.10g
b.无论有氧或无氧条件下,随着苯初始浓度的增加,光催化效率降低
c.相同条件下,有氧光催化降解苯的速率比无氧条件下快
d.有氧条件下,TiO2光催化降解甲苯生成苯甲酸的反应,原子利用率是100%
e.无氧条件下,降解产物中的氧元素来源于TiO2
f.在甲苯降解实验过程中,检测到一种有机中间产物,该产物可能是苯甲醛
(4)工业上TiO2的提纯方法是:
第一步TiO2+2C+2Cl2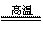 TiCl4+2CO 第二步TiCl4+O2
TiCl4+2CO 第二步TiCl4+O2 TiO2+2Cl2
TiO2+2Cl2
用该方法提纯TiO2的优点是____________。
(5)化学上规定,通常条件下,稳定单质的生成焓(△H)为0,由稳定单质化合生成1mol某化合物时所放出或吸收的热量,称作该化合物的标准生成焓。如:
C(石墨)+O2(g)=CO2(g) △H=-393.5kJ·mol-1
CO2(g)的标准生成焓是-393.5 kJ·mol-1。
有关物质的标准生成焓如下表:
|
物质 |
CO2(g) |
TiCl4(l) |
O2(g) |
TiO2(s) |
Cl2(g) |
|
标准生成焓/ kJ·mol-1 |
-393.5 |
-804.2 |
0 |
-944.7 |
0 |
则液态TiCl4跟O2反应生成固态TiO2和Cl2的热化学方程式是________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com