
18.室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示。已知CaCO3的容度积(室温)为2.8×10-9,下列说法中不正确的是 ( )
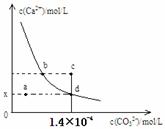
A.x的数值为2×10-5
B.c点时有CaCO3生成
C.加入蒸馏水可使溶液由d点变成a点
D.b点与d点对应的容度积相等
17.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4 Mgx Mo3S4 ;在镁原电池放电时,下列说法错误的是 ( )
Mgx Mo3S4 ;在镁原电池放电时,下列说法错误的是 ( )
A.Mg2+向正极迁移 B.正极反应为:Mo3S4+2xe- = Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:xMg - 2xe- = xMg2+
16.某有机物A(C8H16O2)能发生下图所示的变化,其中C与F是同分异构体。则符合条件的A的同分异构体有多少种 ( )

A.1种 B.2种 C.3种 D.4种
15.钢铁“发蓝”是将钢铁制品浸到某些氧化性的溶液中,在钢铁的表面形成一层四氧化三铁的技术过程。其中一种办法是将钢铁制品浸到亚硝酸钠和浓氢氧化钠的混合溶液中加热到130℃反应。其过程可以用如下化学方程式表示:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+H2O+NH3↑;
② 6Na2FeO2+NaNO2+5H2O = 3 Na2Fe2O4+ NH3↑+7NaOH;
③ Na2FeO2+ Na2Fe2O4+2H2O = Fe3O4+4NaOH;
下列说法不正确的是 ( )
A.该生产过程会产生污染
B.反应②中的氧化剂是NaNO2
C.整个反应过程中每有16.8gFe参加反应转移0.8mol电子
D.反应①②③均是氧化还原反应
13.下列离子方程式书写正确的是 ( )
A.KI溶液中滴加过氧化氢溶液:2I-+H2O2=I2+O2+2H+
B.石灰乳中通入氯气:Cl2+2OH-=Cl-+ClO-+H2O
C.用石墨电极电解硝酸银溶液:4Ag++2H2O 4Ag↓+ O2↑+4H+
4Ag↓+ O2↑+4H+
D.向烧碱溶液中滴加过量的碳酸氢钙溶液:
Ca2++2HCO3-+2OH-==CaCO3↓+2H2O十CO32-
|
A.分散系的分类分散系微粒直径(nm)
B.AlCl3溶液中滴加NaOH溶液后Al元素的存在形式
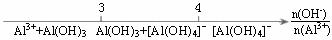
C.C与O2燃烧反应的产物
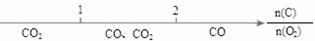
D.Na与O2反应的产物 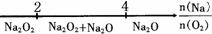
12.常温下,下列有关叙述正确的是 ( )
A.NaB溶液的pH=8,c(Na+)+c(B–)=0.99×10–6mol/L
B.Na2CO3溶液中,2c(Na+)=c(CO32–)+c(HCO3–)+c(H2CO3)
C.c(NH4+)=c(Cl-)的NH4Cl和氨水的混合溶液,其pH可能等于或大于7
D.10 mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积(假设混合后的体积是两溶液体积之和)V(总)≥20mL
11.常温离子液体(Ionic Liquid)也称常温熔融盐。硝酸乙基铵((C2H5NH3)NO3)是人类发现的第一种常温离子液体,其熔点为12℃。已知C2H5NH2结合质子的能力比NH3略强,下列有关硝酸乙基铵的说法正确的是 ( )
A.可用作电池的电解质 B.水溶液呈碱性
C.是共价化合物 D.结构和性质类似于硝酸乙酯
10.在密闭容器中,反应X2(g)+Y2(g)  2XY(g)
△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
2XY(g)
△H<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是 ( )
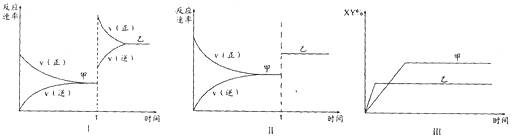
A.图I是加入适当催化剂的变化情况 B.图II是扩大容器体积的变化情况
C.图III是增大压强的变化情况 D.图III是升高温度的变化情况
9.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用酚酞作指示剂,下列操作可能使测定结果偏低的是 ( )
A.酸式滴定管在装液前未用标准盐酸溶液润洗2-3次
B.实验开始时,酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶溶液颜色变化由浅红色变为无色时,立即记下滴定管液面所在刻度
D.盛氢氧化钠溶液的锥形瓶滴定前用氢氧化钠溶液润洗
8.下列实验操作或原理不正确的是 ( )
A.纸层析法中的展开剂之所以能够展开的主要原理是毛细现象
B.分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒
C.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
D.测定溶液pH的操作:将pH试纸置于表面皿上,用洁净玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com