
6.4月22日是“世界地球日”,我国国土资源部确定2005年“世界地球日”的主题为“善待地球--科学发展,构建和谐”。你认为下列行为中不符合这一主题的是( )
A.开发太阳能、水能、风能、可燃冰等新能源、减少使用煤、石油等化石燃料
B.控制含磷剂的生产和使用,防止水体富营养化,保护水资源
C.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
D.实现资源的“3R”利用观,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环再生(Recycle)
29.相对分子质量为174的有机物M中只含有C、H、O三种元素,其分子结构如图所示。请回答下列问题:
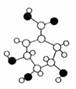
(1)M的分子式是 。
(2)下列关于M的说法,正确的是 。
A.遇FeCl3溶液呈紫色
B.遇紫色石蕊溶液变红色
C.遇溴水发生取代反应
D.能缩聚为高分子化合物
(3)M在一定条件下可发生反应,生成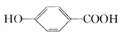 ,该反应的化学方程式
,该反应的化学方程式
是 。反应类型 。
(4)M与有机物A在一定条件下生成一种相对分子质量为202的酯类物质。A可能的结构简式是 。
28.脱除天然气中的硫化氢既能减少环境污染,又可回收硫资源。
(1)硫化氢与FeCl3溶液反应生成单质硫,其离子方程式为 。
(2)用过量NaOH溶液吸收硫化氢后,以石墨作电极电解该溶液可回收硫,其电解总反应方程式(忽略氧的氧化还原)为 ;该方法的优点是 。
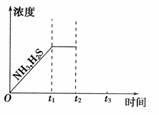
(3)一定温度下,1mol NH4HS固体在定容真空容器中可部分分解为硫化氢和氨气。
①当反应达平衡时,P氨气×P硫化氢=a(Pa2),则容器中的总压为 Pa;
②下图是上述反应过程中生成物浓度随时间变化的示意图。若t2时增大氨气的浓度且在t3时反应再次达到平衡,请在图上画出t2时刻后氨气、硫化氢的浓度随时间的变化曲线。
27.硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
提出问题:Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
实验探究:基于上述猜想②、③,设计实验方案。
|
|
实验操作 |
实验现象或 预期实验现象 |
现象解释(用离子 方程式表示) |
|
猜想② |
|
溶液pH=8 |
- |
|
向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O32-+2H+=== S↓+SO2↑+H2O |
|
|
猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
|
实验结果:Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
问题讨论:
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由
。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是
。
写出Na2S2O3被Cl2氧化的离子反应方程式: 。
26.A-H是中学化学常见的物质,已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。
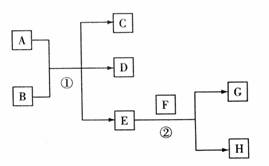
请回答下列问题:
(1)若A、C、D均含有氯元素,且A的化合价介于C与D之间,写出稀溶液中①的离子方程式: 。
(2)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B分别为 。(写化学式)
(3)若A与B均为固体化合物,该反应是实验室制备D气体的反应,且C是一种常见的中性干燥剂,则反应①的化学方程式为 ;写出A、B的电子式A ,B 。
(4)若A为红褐色难溶于水的固体,B为第(1)题中的某一产物,两者在浓碱溶液中发生反应生成了高效环保的净水剂Na2FeO4,请写出此反应的离子方程式:
。
13.电解100ml含CH+=0.30mol·L-1的下列溶液,当电路通过0.04mol电子时,理论上析出金属质量最大的是 ( )
A.0.10 mol·L-1 Ag+ B.0.20 mol·L-1 Zn2+
C.0.20 mol·L-1 Cu2+ D.0.20 mol·L-1 Pb2+
12.下列各组中的两种物质相互反应时,无论哪种反应物过量,都可以用同一离子方程式表示的是 ( )
A.碳酸钠和盐酸 B.氨水和硝酸银
C.CO2通入澄清石灰水 D.苯酚溶液和CO2
11.下列物质不能通过化合反应得到的是 ( )
①Fe(OH)3 ②Al2S3 ③FeCl2 ④FeCl3 ⑤SO3
⑥CO ⑦H2SiO3 ⑧NaHCO3 ⑨CaCO3
A.③⑥⑦⑨ B.⑦⑨ C.仅⑦ D.③⑤⑥⑦⑧⑨
10.下列物质甲、乙以2:1物质的量比混合,同时通入过量丙溶液中,一定产生沉淀的组合是 ( )
|
序号 |
甲 |
乙 |
丙 |
|
① |
CO2 |
SO2 |
BaCl2 |
|
② |
NH3 |
CO3 |
CaCl2 |
|
③ |
SO2 |
Cl2 |
Na2S2O3 |
|
④ |
HCl |
CO2 |
Ba(OH)2 |
|
⑤ |
H2S |
CO2 |
饱和Na2CO3 |
A.①②③④ B.②③④⑤ C.①②③⑤ D.①③④⑤
9.现有一包铝热剂是铝粉和氧化铁粉末的混合物,在高温下使之充分反应,将反应后的固体分为两等份,进行如下实验(计算pH时假定溶液体积没有变化):
①向其中一份固体中加入100mL 2.0mol·L-1的NaOH溶液,加热使其充分反应后过滤,测得滤液的pH=14;
②向另一份固体中加入100mL 4.0 mol·L-1的HCl溶液,使固体全部溶解,测得反应后所得溶液中只有H+、Fe2+和Al3+三种阳离子且pH=1。
则②产生气体的体积(标准状况)为 ( )
A.2.352L B.2.448L C.2.688L D.2.856L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com