
8.制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 ( )
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
7.离子检验的常用方法有三种
|
检验方法 |
沉淀法 |
显色法 |
气体法 |
|
含义 |
反应中有沉淀产生或溶解 |
反应中有颜色变化 |
反应有气体产生 |
下列离子检验的方法不合理的是 ( )
A.NH4+用气体法 B.Cl-用沉淀法 C.Fe3+用气体法 D.OH-用显色法
6.设阿伏伽德罗常数的值为NA,则下列说法中正确的是 ( )
A.常温常压下,11.2L N2所含的原子数目为NA
B.标准状况下,11.2L H2O中含有的电子数为5NA
C.常温下,1mol Al2(SO4)3中含Al3+数为2NA
D.常温下,2.7g铝与足量的盐酸反应,产生氢气的分子数为0.1NA
33.(8分)[化学-有机化学基础]
利用芳香烃X和链烃Y可以合成紫外线吸收剂BAD,已知G不能发生银镜反应,BAD结构简式为:
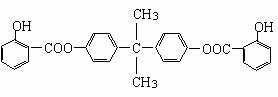
BAD的合成路线如下:
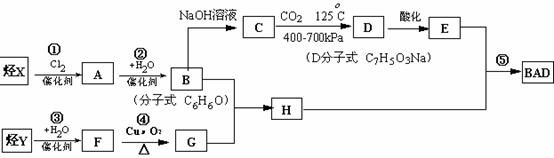
试回答
(1)写出结构简式 D 、 H 。
(2)属于取代反应的有 (填数字序号) 。
(3)1molBAD最多可与含 molNaOH的溶液完全反应
(4)写出反应④的化学方程式 。
32.(8分)[化学-物质结构与性质]
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A原子核外有三个未成对电子;A与B可形成离子化合物B3A2;C元素是地壳中含量最高的金属元素;D原子核外的M层中有两对成对电子;E原子核外最外层 只有1个电子,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)E的核外电子排布式是 ,A、B、C、D的第一电离能由小到大的顺序为 。
(2)B的氯化物的熔点远高于C的氯化物的熔点,理由是 ;
(3)A的最高价含氧酸根离子中,其中心原子采取 杂化,D的低价氧化物分子的空间构型是 。
(4)A、E形成某种化合物的晶胞结构如图所示,则其化学式为 ;(每个球均表示1个原子)
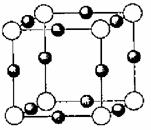
31.(8分)[化学-化学与技术]
海水中溶解了大量的气体物质和各种盐类。人类在陆地上发现的100多种元素,在海水中可以找到80多种。海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法,技术和工艺比较完备,但由于使用大量燃煤,因此能耗多、排污量大。为克服蒸馏法海水淡化的缺陷,请你对蒸馏法淡化海水的工艺提出一条改进建议 。
(2)使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 。
(3)空气吹出法是目前从海水中提取溴的常用方法,流程如下(苦卤:海水蒸发结晶分离出食盐后的母液):
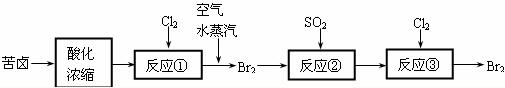
①反应②的离子方程式为 ;
②从反应③后的溶液中分离出单质溴的方法是 。
30.(13分)硫酸铜是一种应用极其广泛的化工原料,可通过多种途径制取硫酸铜晶体。铜不能与稀硫酸直接反应,某化学活动小组设计实验如下:将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1所示)
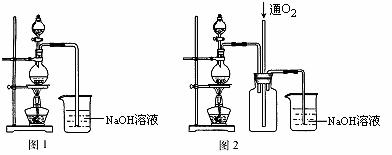
请回答相关问题:
(1)图1分液漏斗中装的液体是 ;
(2)烧瓶内发生反应的离子方程式为 ;
(3)图2是图1的改进装置,其优点是① , ② ;
(4)该化学活动小组要用无水硫酸铜检验少量水的存在。由于无水硫酸铜吸湿性很强,需要用上述实验得到的硫酸铜晶体现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于研钵中研碎后放入坩埚,将坩埚放在
上用小火慢慢加热并 ,最后将坩埚移入 中进行冷却。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),用玻璃棒充分搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。该方法中,浓硫酸的作用是 ;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是 ,所用的主要玻璃仪器有 等。
[选做部分]
29.(16分)有A、B、C、D、E五种短周期元素,其元素特征信息如下表:
|
元素编号 |
元素特征信息 |
|
A |
其单质是密度最小的物质 |
|
B |
最外层电子数是内层电子数的2倍 |
|
C |
阴离子带有两个单位的负电荷,单质是空气的主要成分之一 |
|
D |
其阳离子与C的阴离子具有相同的电子层结构,且核电荷数与C相差5 |
|
E |
最高正价与负价的代数和为4,原子半径大于C |
请回答下列问题:
(1)写出B、E二种元素的元素符号B: E: 。
(2)五种元素中的三种组成的易溶于水的物质中,能促进水电离的物质M是
(写化学式),能抑制水电离的物质N是 (写化学式,写一个即可)。25℃时,pH=a的M溶液中水电离出的H+浓度与pH=a的N溶液中水电离出的H+浓度之比为 。
(3)甲、乙分别是B、D二种元素最高价含氧酸的钠盐,丙是E元素最高价氧化物的水化物,甲、乙都能与丙发生反应,且丙用量不同,反应的产物不同。回答问题:
①向乙溶液中缓慢滴加过量的丙溶液过程中发生的所有反应的离子方程式 ;
②向100mL甲溶液中缓慢滴加等浓度的50mL丙溶液后,所得溶液中离子浓度由大到小的顺序为 ;
(4)航天飞机曾用D的粉末和高氯酸铵混合物作为固体燃料。加热D粉使其氧化并放出大量热量,促使高氯酸铵分解。n mol高氯酸铵分解时除产生2n mol水蒸气和n mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出高氯酸铵分解的化学方程式 ,该反应中的氧化产物为 ,每分解1mol高氯酸铵,转移的电子数目是 。
28.(13分) I、向一定体积的密闭容器中加入一定量的 A、B、C三种气体。一定条件下发生反应,各物质浓度随时间变化如图I所示,其中t0~t1 阶段c(B)变化未画出。图Ⅱ为 t2时刻后改变反应条件,化学反应速率随时间变化的情况,三个阶段改变的条件均不相同,每个阶段只改变浓度、温度、压强中的一个条件。
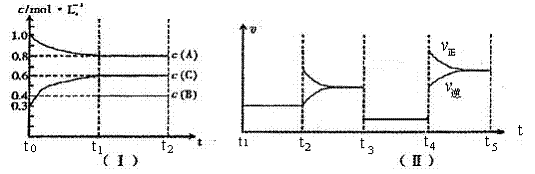 请回答下列问题:
请回答下列问题:
(1)t3 ~t4阶段改变的条件为_______,该反应是 (填“吸热”或“放热”)反应;
(2)B的转化率为______________;
(3)各阶段平衡时对应的平衡常数如下表所示:
|
t1~t2 |
t2~t3 |
t3~t4 |
t4~t5 |
|
K1 |
K2 |
K3 |
K4 |
则 K1= (保留两位小数), K1、K2、K3、K4之间的关系为 (用“>”、“<”或“=”连接);
II.工业上用“三氯氢硅还原法”提纯粗硅的工艺流程如下图所示:
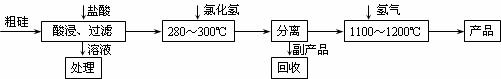
(1)三氯氢硅的制备原理:Si(s)+3HCl(g)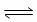 SiHCl3(g)+H2(g) △H=-210 kJ/mol
SiHCl3(g)+H2(g) △H=-210 kJ/mol
除上述反应外,还伴随着副反应:Si(s)+4HCl(g) SiCl4(g)+2H2(g) △H=-241 kJ/mol。
SiCl4(g)+2H2(g) △H=-241 kJ/mol。
反应SiHCl3(g)+HCl(g) SiCl4(g)+H2(g)的△H= kJ/mol。
SiCl4(g)+H2(g)的△H= kJ/mol。
(2)在1100~12000C条件下,SiHCl3与H2反应的化学方程式为 ;
(3)该生产工艺中可以循环使用的物质是 。
15.已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是 ( )
A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O
B.Cu2+ + H2S = CuS↓+ 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
第Ⅱ卷
[必做部分]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com