
7.下列各溶液中能大量共存的离子组是 ( )
A.使酚酞试液呈红色的溶液中:Mg2+、Cu2+、SO42-、K+
B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3- 、Cl-
C.c(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO32-
D.水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、 HCO3-、Ca2+
6.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.20g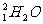 中所含的中子数为10NA
中所含的中子数为10NA
B.在标准状况下,11.2L四氯化碳所含的分子数为0.5NA
C.24g镁在足量的CO2中燃烧转移的电子数为4NA
D.28.6g
Na2CO3·10H2O中所含的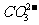 数目小于0.1NA
数目小于0.1NA
28.(16分)X、Y、Z为周期表中前20号主族元素,原子序数递增,X、Y原子的最外层电子数是其电子层数的2倍,Z是人体含量最高的金属元素。
(1)下列含氧酸根化学式书写不正确的是 (填序号)。
a.XO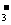 b.XO
b.XO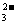 c.YO
c.YO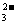 d.Y2O
d.Y2O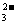
(2)X、Y的原子可构成只含极性键的非极性分子,它的电子式是 ,
空间构型是 。
(3)Y的最高价含氧酸是重要的化工产品。
①已知YO2被空气氧化,每生成1mol气态YO3,放出98.3kJ热量。该反应的热化学方程式是 。
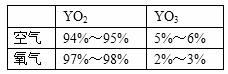
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的成分(体积分数)如表。Y在纯氧中燃烧产物是YO3含量比空气中少的原因是 。
③天然ZYO4既可用于制备Y的氧化物又可用于制定水泥。ZYO4与X单质在高温下反应,得到两种常见气体。每消耗1molX单质,有4mol电子转移,该反应的化学方程式是 。
(4)为了测量某水泥样品成分,称取10.0g样品,将其中的Z元素转化为ZX2O4沉淀,将沉淀用稀酸处得H2X2O4溶液,取该溶液体积1/100,用HMnO4溶液滴定(氧化产物为XO2,还原产物为Mn2+),结果用去0.0200mol·L-1的HMnO4溶液24.00mL。该样品中Z的氧化物的质量分数是 。
27.(16分)氯气、氨气等物质在生产和科研中都有重要应用。
(1)若发后大量氯气汇漏事故,下列措施中正确的是 。
a.立即通报相关部门,迅速撤离事故现场
b.用蘸有肥皂水的毛巾捂住口鼻立即逆风疏散
c.用蘸有NaOH溶液的毛巾捂住口鼻立即顺风疏散
(2)事故发生后,可用NaOH稀溶液处理汇漏的氯气,反应的离子方程式是 。
(3)实验室用氨气还原氧化铜的方法,通过测定反应物CuO和生成物H2O的质量
[m(CuO)、m(H2O)],测定铜的近似相对原子质量。反应的化学方程式是:
2NH3+3CuO N2+3Cu+3H2O。各选仪器装置如下(装置内所发生的反应是完全的)。
N2+3Cu+3H2O。各选仪器装置如下(装置内所发生的反应是完全的)。
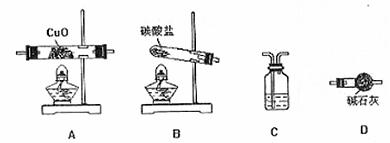
①用上述实验装置制氨气时,能否将碳酸盐换成氯化铵? (回答“是”或“否”)用化学方程式说明理由 。
②仪器从左到右的连接顺序(用字母编号表示,仪器可重复使用)是 。
C中的试剂是 ,其作用是 。
③铜的相对原子质量是 (用含有m(CuO)、m(H2O)的式子表示)。
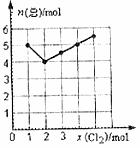
(4)Cl2与NO2在一定条件下发生化合反应,生成一种气体,实验数据如图。图中横坐标是加入Cl2的物质的量,纵坐标是反应后气体物质的量总和。已知所取Cl2、NO2的物质的量总和为6mol。则生成物的化学式是 。
26.(13分)M、R都是生活中常见的金属单质,其中R是用量最多的金属。甲、乙化合物,其是甲是黑色晶体,可由R在X中燃烧得到。
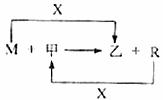
(1)M与甲在高温下反应的化学方程式是 。
(2)电解法制R低价氢氧化物的装置如图。A是4mol·L-1NaCl、1mol·L-1NaOH的混合溶液。
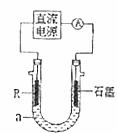
①配制a时需要除去蒸馏水中溶解的O2,常采用 的方法。
②石墨电极应与电源的 (填“正”或“负”)极相连接,通电后,R电极附近的现象是 ,R极的电极反应式是 。
③停止实验一段时间后,在R极上都有红色褐色物质产生,反应的化学方程式是 。
(3)把R的某氧化物粉末与M粉末混合后分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是a:b,则R的氧化物的化学式是 。
25.(15分)食用香料A分子中无支链,B分子中无甲基。B能使Br2的CCl4溶液褪色,1molB与足量Na反应生成0.5molH2。各物质间有如下转化。
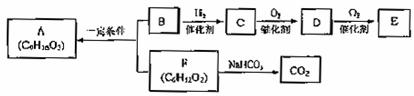
试回答:
(1)在一定条件下能与C发生反应的是 。
a.Na b.Na2CO3 c.Br2/CCl4 d.CH3COOH
(2)D分子中的官能团名称是 ,E的结构简式是 。
(3)B与F反应生成A的化学方程式是 。
(4)F的同分异构体甲能发生水解反应,其中的一种产物能发生银镜反应;另一产物在光照条件下的一氯取代物只有两种,且催化氧化后的产物也能发生银镜反应。甲的结构简式是 。
(5)已知:
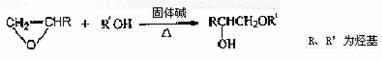
乙是C的同系物,其催化氧化产物在常温下为气态。由乙出发可以合成有机溶剂成(C7H14O3)。丁分子中有2个甲基。
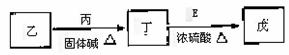
戊的结构简式是 。
12.短周期元素X、Y、Z的离子具有机同的核外电子排布,原子半径X大于Z,离子半径Y大于Z,Y与Z可形成常见的离子化合物,则下列说法中不正确的是 ( )
A.原子序数一定是Z>X>Y
B.X、Z两种元素的单质的沸点一定是Z>X
C.Z的最高价氧化物一定能溶于X、Y的最高价氧化物的水化物
D.工业上获得X、Z单质的方法主要是电解
第II卷(非选择题 21-31题共11分 共180分)
11.今有室温下四种溶液:①pH=11的氨水、②pH=11的NaOH溶液、③pH=3的醋酸、④pH=3的硫酸。下列有关说法不正确的是 ( )
A.①、②中分别加入适量的氯化铵晶体后,两溶液的pH均减小
B.分别加水稀释10倍,四种溶液的pH ①>②>④>③
C.①\④两种溶液混合后,若溶液呈中性,则所得溶液中2c(NH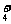 )=c(SO
)=c(SO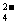 )
)
D.V1L④与V2L②溶液混合后,若混合后溶液PH=4,则V1:V2=11:9
10.下列说法正确的是 ( )
A.含有0.5molNa2CO3的溶液中溶质的离子总数为1.5×6.02×1023
B.7.8g过氧化钠所含有阴离子数为0.2×6.02×1023
C.标准状况下,2.24L乙酸的分子数为0.1×6.02×1023
D.标准状况下,1.12LH2和Cl2混合气体分子总数为0.05×6.02×1023
9.下列有关叙述正确的是 ( )
①除去苯中的苯酚:加入浓溴水后,过滤
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液
③除去CO2中少量的SO2:气体通过盛有NaOH溶液的洗气瓶
④除去碳酸钠中少量的碳酸氢钠:将混合物灼热
A.②④ B.③④ C.①② D.只有②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com