
22.(10分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A B C D
(2)写出AB2与过量氢氧化钠反应的离子方程式
(3)用电子式表示化合物 C2D的形成过程 。
(4)C的单质在高温下与B的单质充分反应所得化合物中含有化学键为 。
21.(12分)按要求用合适的化学用语填空
Ⅰ.(8分)在原子序数1-18号元素中:
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)原子半径最小的元素是_____________。
(4)气态氢化物最稳定的化学式是_____________。
(5)最高价氧化物对应水化物的酸性最强的化学式是_____________。
(6)电子数为10的分子(写5个)
Ⅱ.(4分)下列各分子中,所有原子都满足最外层为8电子结构的是
①H2O ②BF3 ③CF2Cl2 ④PCl3 ⑤.SO3 ⑥N2 ⑦COCl2
20.下列各组物质中,两种物质所含化学键类型不同的是 ( )
A.H2O和HNO3 B.CaF2和Na2O2
C.NaCl和MgO D.Cl2和P4
19.镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是
A.在化合物中呈+2价 B.单质使水分解、放出氢气
C.氢氧化物呈两性 D.镭的还原性大于镁
18.下列化合物电子式书写正确的是 ( )
A.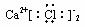 B.
B.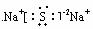 C.
C.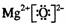 D.
D. 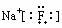
17.Y元素最高正价与负价的绝对值之差是6;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是 ( )
A.KCl B.NaF C.Na2O D.K2S
15.元素周期表的过渡金属中能找到 ( )
A.新制农药元素 B.强氧化剂
C.制半导体元素 D.制耐高温合金元素
|
A.它的最外层电子数为4 B.它的金属性比铅强
C.它具有+2、+4价 D.它的最高价氧化物的水化物是强酸
14.根据元素周期表和元素周期律,下列推断中错误的是 ( )
A.砹是一种有色固体,它的气态氢化物很不稳定,
B.F2与水反应比Cl2与水反应剧烈
C.铷的硫酸盐易溶解于水,其氢氧化物一定是强碱
D.溴化氢比氯化氢稳定,HClO4酸性强于HBrO4
13.同一周期X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性是:
HXO4 >H2YO4 >H3ZO4 ,则下列判断错误的是 ( )
A.原子半径:X > Y > Z B.气态氢化物的稳定性:HX > H2Y > ZH3
C.非金属性:X > Y > Z D.阴离子的还原性:Z3- > Y2- > X-
12.下列反应中,属于吸热反应的是 ( )
A.实验室制H2的反应 B.实验室制CO2的反应
C.水的分解反应 D.生石灰与水的反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com