
7.以下贮存物质的方法正确的是 ( )
A.浓硝酸保存在带有橡胶塞的试剂瓶中
B.水玻璃贮存在带玻璃塞的玻璃瓶中
C.少量钠贮存在酒精中
D.少量钠贮存在煤油中
6.2007年诺贝尔化学奖是表彰在表面化学领域取得的成就。某反应在Pd/Al2O3Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),图示机理是指 ( )
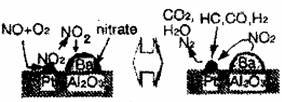
A.汽车尾气催化转化机理
B.钢铁生锈机理
C.合成氨工业催化氧化机理
D.氢氧燃烧电池电极反应机理
29.(15分)
已知A只能由某种烯烃与氢气加成而得到,且A分子中含碳82.8%;B、C分别为A的氯代物,且在题设条件下,B、C转化为D时,D是唯一有机产物。A~I各有机物有如下转化关系(反应中生成的无机物已略去)。
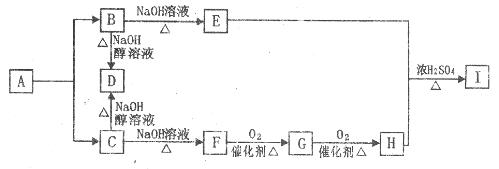
回答下列问题;
(1)A的分子式是:________________,A的结构简式为__________________;
(2)F的官能团的名称是_____________________________;
(3)写出D在一定条件下发生加聚反应的化学方程式;_______________________;
(4)C→D的化学方程式为:
________________________________________,反应类型为_________________;
(5)E+H→I的化学方程式为:________________________________________________;
(6)G可发生银镜反应,3.6gG与足量银氨溶液完全反应,生成Ag的质量为________g。
28.(16分)
某课外活动小组的同学针对乙醇的催化氧化作了如下探究实验;
(1)把一端弯成螺旋状的钢丝放在酒精灯外焰加热,待钢丝表面变黑后立即把它插入盛约2mL乙醇的试管里,反复操作几次。可能出现的现象是;
_______________________________________________________________________;
(2)该小组进一步利用下图装置进行乙醇的催化氧化实验并制取乙醇,图中铁架台等装置已略去,粗黑线表示乳胶管。
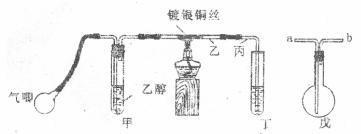
回答下列问题;
Ⅰ.甲装置常常浸入70~80℃的水浴中,目的是_______________________.
Ⅱ.实验时,先加热玻璃管乙中的钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态。热把酒精灯撤走,控制一定的股气速度,钢丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是______________反应(填“放热”或“吸热”),该反应的化学方程式为___________________________________________________;
②控制鼓气速度的方法是_____________________________________________,热鼓气速度过快则会__________________________________________________,热鼓气速度过慢则会__________________________________________________。
Ⅲ.若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号);乙接________、_______接丙;若产物不用水吸收而是直接冷却,应将试管丁浸在___________________中。
27.(15分)
下面两图中的各物质均是中学化学中的常见物质。在各转化关系中,有的反应生成的水标出。C是一种重要的化工产品。E是一种常用化肥,J是目前世界上应用范围和用量最大的金属。每1molG与I均含有10mole ,每1molX与D均含有18mole
,每1molX与D均含有18mole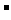 。H是空气的主要成分之一,B是大气的主要污染物之一,且M与N的组成元素相同。
。H是空气的主要成分之一,B是大气的主要污染物之一,且M与N的组成元素相同。
回答下列问题:
(1)X的电子式为_______________________________;
(2)写出反应①的化学方程式_____________________________________________;
(3)写出反应②的离子方程式_____________________________________________;
(4)工业上生产C,是用燃烧黄铁矿(FeS )的方法制得B,进而通过其他流程得到C。已知黄铁矿(FeS
)的方法制得B,进而通过其他流程得到C。已知黄铁矿(FeS )的燃烧热为-853KJ/mol,写出该反应的热化学方程式;
)的燃烧热为-853KJ/mol,写出该反应的热化学方程式;
_______________________________________________________________________;
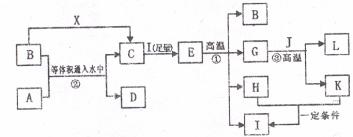
(5)关于L与稀硫酸的反应,有不同看法。一般认为有关物质可按下图方式进行反应;
Ⅰ.按此理解,写出L与稀硫酸反应的离子方程式;
_______________________________;
Ⅱ.可通过实验对上一反应作初略的验证,简述验证过程;
①__________________________________________________________________;
②__________________________________________________________________;
③__________________________________________________________________;
26.(14分)
合成氨工业对我国实现农业现代化起着很重要的作用,工业合成氨的原理是:
N2+3H2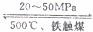 2NH3;
△H<0生产流程如图所示。回答下列问题
2NH3;
△H<0生产流程如图所示。回答下列问题
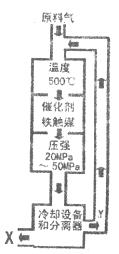
(1)①图中X的化学式为______________;
②条件选定的主要原因是(选填字母序号 )_____________-;
A.升高温度、增大压强有利于提高氨的转化率
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③达到平衡后,若改变反映条件,会使平衡发生移动。下图表示
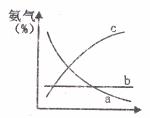
随条件改变,氨气的百分含量的变化趋势。
当横坐标为压强时,变化趋势正确的是(选填字母序列号)________;
当横坐标为温度时,变化趋势正确的是(选填字母序列号)________;
(2)设在2.0L密闭容器中充入0.6molN (g)和1.6molH
(g)和1.6molH (g),反应在一定条件下达到平衡时,NH
(g),反应在一定条件下达到平衡时,NH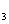 的物质的量分数为4/7,此时,N
的物质的量分数为4/7,此时,N 的平衡转化率为________________。
的平衡转化率为________________。
(3)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水且氨水显弱碱性的过程:
_______________________________________________________;
②氨水中水电离出的e(OH )_________10
)_________10 mol·L
mol·L (填写“>”,“<”或“=”);
(填写“>”,“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为____________________________________________。
13.将一定质量的锌与10mL 18.5mol·L 浓硫酸充分反应,锌完全溶解,同对生成标准状况下的气体3.36L 。将反应后的溶液稀释至100mL,测得溶液中c(H
浓硫酸充分反应,锌完全溶解,同对生成标准状况下的气体3.36L 。将反应后的溶液稀释至100mL,测得溶液中c(H )=0.1mol·L
)=0.1mol·L ,则投入的锌的质量是
,则投入的锌的质量是
A.6.5g B.9.75g C.13g D.16.25g
12.在容积恒定的密闭容器中充入2molA和1molB,发生反应2A(g)+B(g) xC(g)达到平衡后,C的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量A为0.6mol、B为0.3mol、C为1.4mol充入容器中,达到平衡后,C的体积分数仍为a%,则x的值是
xC(g)达到平衡后,C的体积分数为a%;若维持容器的容积和温度不变,按起始物质的量A为0.6mol、B为0.3mol、C为1.4mol充入容器中,达到平衡后,C的体积分数仍为a%,则x的值是
A.可能为2,也可能为3 B.只能为2
C.只能为3 D.无法确定
11.某溶液含有NaCl和H SO
SO 两种溶质,它们的物质的量之比为2:1。用石墨作电极电解该混台溶液时,根据电极产物,可明显地分为二个阶段。下列叙述中错误的是
两种溶质,它们的物质的量之比为2:1。用石墨作电极电解该混台溶液时,根据电极产物,可明显地分为二个阶段。下列叙述中错误的是
A.阴极始终只析出H B.阳极先析出Cl
B.阳极先析出Cl ,后析出O
,后析出O
C.电解的最后阶段是电解水 D.溶液的pH不断增太,最后pH大于7
10.下列各选项所述的两个量,前者一定大于后者的是
①纯水在25℃和80℃时的pH;②HF和HBr的沸点;③同温下分别在100g水中最多能溶解的无水CuSO 和CuSO
和CuSO ·5H
·5H O的质量:④25℃时,等体积的pH都等于3的盐酸和AlCl
O的质量:④25℃时,等体积的pH都等于3的盐酸和AlCl 溶液中,已电离的水分子数;⑤NH
溶液中,已电离的水分子数;⑤NH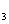 和SiH
和SiH 的稳定性;⑥H
的稳定性;⑥H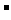 和H
和H 离子半径;⑦金刚石晶体和石墨晶体中,每个最小碳环的所含的实际碳原子数
离子半径;⑦金刚石晶体和石墨晶体中,每个最小碳环的所含的实际碳原子数
A.①②⑤⑥ B.②④⑤⑦ C.②③④⑥ D.①②③⑦
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com