
题目列表(包括答案和解析)
1. 一定质量的气体,在温度不变时,体积增大,压强减小.
3.压强。气体的压强是由于气体分子频繁碰撞器壁而产生的.
压强的国际单位是帕,符号Pa,常用的单位还有标准大气压(atm)和毫米汞柱(mmHg)。它们间的关系是:1 atm=1.013×105Pa=760mmHg;
1 mmHg=133.3Pa。
2.体积。气体总是充满它所在的容器,所以气体的体积总是等于盛装气体的容器的容积。
1.温度
(1)两种意义:宏观上表示物体的冷热程度;微观上标志着分子热运动的激烈程度,它是物体分子平均动能的标志。
(2)两种温标
①摄氏温标t:单位为单位℃.在1个标准大气压下,水的冰点作为0℃,沸点作为100℃.
②热力学温标T:单位K(开尔文).把-273℃作为0K,0K是低温的极限,它表示所有分子都停止了热运动。可以无限接近,但永远不能达到。
③两种温度的关系:T = t+273.15K和ΔT =Δt,要注意两种单位制下每一度的间隔是相同的。
能量守恒定律是自然界普遍适用的规律之一,是研究自然科学的强有力的武器之一.定律的数学表达式一般为恒量式和增量式两类: 1.恒量式:E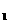 =E
=E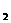 ,即转化前各种形式(或各个物体)能量的总和E
,即转化前各种形式(或各个物体)能量的总和E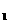 等于转化后各种形式(或各个物体)能量的总和E
等于转化后各种形式(或各个物体)能量的总和E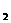 2.增量式:
2.增量式: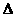 E
E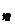 =
=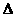 E
E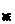 ,即一些形式(或一些物体)能量的增加量等于另一些形式(或另一些物体)能量的减少量。当问题中没有涉及全部参与转化的能量或参与能量转化的全部物体时,则用含能量转化效率的表达式
,即一些形式(或一些物体)能量的增加量等于另一些形式(或另一些物体)能量的减少量。当问题中没有涉及全部参与转化的能量或参与能量转化的全部物体时,则用含能量转化效率的表达式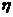 E
E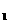 =E
=E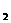 或
或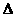 E
E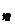 =
=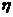
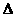 E
E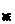 .在应用能的转化与守恒定律解决问题时,关键是分析清楚能量转化的形式和转化的方向,问题中有哪些形式的能量参与了转化?它们的转化各对应着什么样的做功过程?同时,要善于应用动能定理、动量守恒定律、牛顿运动定律等力学知识来分析能量转化的过程和做功的过程.其次,要选好定律的数学表达式,使列出的方程最简明,最后要统一单位.
.在应用能的转化与守恒定律解决问题时,关键是分析清楚能量转化的形式和转化的方向,问题中有哪些形式的能量参与了转化?它们的转化各对应着什么样的做功过程?同时,要善于应用动能定理、动量守恒定律、牛顿运动定律等力学知识来分析能量转化的过程和做功的过程.其次,要选好定律的数学表达式,使列出的方程最简明,最后要统一单位.
|

例1. 下列说法中正确的是( )
A. 物体吸热后温度一定升高
B. 物体温度升高一定是因为吸收了热量
C. 0℃的冰化为0℃的水的过程中内能不变
D. 100℃的水变为100℃的水蒸汽的过程中内能增大
解析:吸热后物体温度不一定升高,例如冰融化为水或水沸腾时都需要吸热,而温度不变,这时吸热后物体内能的增加表现为分子势能的增加,所以A不正确。做功也可以使物体温度升高,例如用力多次来回弯曲铁丝,弯曲点铁丝的温度明显升高,这是做功增加了物体的内能,使温度上升,所以B不正确。冰化为水时要吸热,内能中的分子动能不变,但分子势能增加,因此内能增加,所以C不正确。水沸腾时要吸热,内能中的分子动能不变但分子势能增加,所以内能增大,D正确
变式训练1:下列说法中正确的是( )
A. 温度相同时,不同物质的分子平均动能相同
B. 温度相同时,不同物质的分子平均速率相同
C. 热量、功、内能三者的物理意义不同
D. 热量和功都可以作为物体内能的量度.
解析:温度是分子平均动能的标志,选项A正确;热量和功是改变物体内能的两种方式,所以可以量度内能的改变,但不能量度内能,内能是状态量,三者的物理意义不同,所以选项C对而D错.
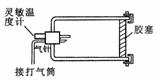 例2.如图8-2-1所示,厚壁容器的一端通过胶塞插进一支灵敏温度计和一根气针,另一端有个用卡子卡住的可移动胶塞.用打气筒慢慢向容器内打气,使容器内的压强增大到一定程度,这时读出温度计示数.打开卡子,胶塞冲出容器口后( ) 图8-2-1
例2.如图8-2-1所示,厚壁容器的一端通过胶塞插进一支灵敏温度计和一根气针,另一端有个用卡子卡住的可移动胶塞.用打气筒慢慢向容器内打气,使容器内的压强增大到一定程度,这时读出温度计示数.打开卡子,胶塞冲出容器口后( ) 图8-2-1
A.温度计示数变大,实验表明气体对外界做功,内能减少
B.温度计示数变大,实验表明外界对气体做功,内能增加
C.温度计示数变小,实验表明气体对外界做功,内能减少
D.温度计示数变小,实验表明外界对气体做功,内能增加
解析:本题考查了做功与气体内能变化的关系。由于系统是个密闭的厚壁容器,当外界对容器内部打气时,使得内部的压强增大温度升高,此时温度计的示数较原来升高;当打开卡子后气体体积膨胀,对外界做功,使得气体的内能减少温度降低,故温度计的示数变小,选项C正确。
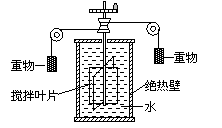
变式训练2:图8-2-2为焦耳实验装置图,用绝热性能良好的材料将容器包好,重物下落带动叶片搅拌容器里的水,引起水温升高。关于这个实验,下列说法正确的是( )
A.这个装置可测定热功当量 B.做功增加了水的热量 图8-2-2
C.做功增加了水的内能
 D.功和热量是完全等价的,无区别
D.功和热量是完全等价的,无区别
解析:做功和传递热量都可以使物体的内能发生改变,焦耳实验中是通过做功来增加水的内能,所以选项C正确;就放体内能的改变来说,做功和热传递是等效的,这是研究热功当量的前提,通过焦耳实验可测定热泪盈眶功当量,所以选项A正确,一个物体的内能是无法测量的,而在某种过程中物体内能的变化却是可以测定的,热量就是用来测定内能变化的一个物体量,所以选项B和D都错。
第3课时 气体
|

2.应用热力学第一定律解题的步骤
(1)确定研究对象,就是要明确内能变化的是哪一个物体或哪一个热力学系统.
(2)定性分析研究对象的内能变化是由外界哪些物体或系统通过哪些过程引起的.
(3)根据符号法则,确定 U、Q、W的正负号,代入公式ΔE=W+Q进行计算。
U、Q、W的正负号,代入公式ΔE=W+Q进行计算。
1.热力学第一定律的表达式ΔU=W+Q,揭示了能的转化和守恒定律,在实际中具有很广泛的应用。在运用ΔU=W+Q来分析问题时,首先必须理解表达式的物理意义,掌握它的符号法则:(1)外界对物体做功,W取正值;物体对外界做功,W取负值。(2)物体吸热,Q取正值;物体放热,Q取负值.(3)物体内能增加,ΔU取正值;物体减少,ΔU取负值.如果事先不便确定其正负,可以先假定它为正,在定量计算出结果后再作出判断.若大于零,说明与原假定的相同,为负则相反。必须指出的是,一般来说系统对外界做功,表现出系统体积膨胀;外界对系统做功,系统体积则被压缩。但在某些特定条件下,例如气体自由膨胀(外界为真空)时,气体就没有克服外力做功.另外,在判断内能变化时,还必须结合物态变化以及能的转化与守恒.
3.热力学第二定律的实质
热力学第二定律的任何一种表述,都揭示了大量分子参与的宏观过程的方向性,使人们认识到自然界中进行的涉及热现象的宏观过程都具有方向性,即一切与热现象有关的实际宏观过程都是不可逆的.因此两种不同的表述是等价的.
|

2.与热力学第一定律的区别
热力学第一定律和热力学第二定律是构成热力学知识的理论基础. 热力学第一定律是跟热现象有关的物理过程中能量守恒定律的特殊表达形式,它说明功、热量与内能改变之间的定量关系.指出在任何热力学过程中能量不会有任何增加或损失. 热力学第二定律指出了能量转化与守恒能否实现的条件和过程进行的方向,它说明一切与热现象有关的实际宏观过程是不可逆的.热力学第二定律解决哪些过程可以发生.揭示了自然界中进行的涉及热现象的宏观过程的不可逆性,是对热力学第一定律的进一步补充. 热力学第一定律和热力学第二定律从不同角度揭示了与热现象有关的物理过程所遵循的规律,二者相互独立,又相互补充,都是热力学的理论基础.
1.热力学第二定律的理解
热力学第二定律的两种表述都有“而不引起其他变化”,这是我们理解这一定律的关键.表述一说明热传导的过程是有方向性的.这个过程可以向一个方向自发地进行,但是向相反的方向不会自发进行.要实现相反方向的过程,必须借助外界帮助,因而产生了其它影响或引起其他变化。也就是说在引起了其他变化的情况下,热量也可以从低温物体传到高温物体;同理,机械能和内能的转化过程具有方向性,机械能可以全部转化成内能,内能也可以全部转化成机械能,而引起其他变化.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com