
2.下列离子方程式不正确的是
A. 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:
Ca2++OH-+HCO3-=CaCO3↓+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:
2Fe2++H2O2+2H+=2Fe3++2H2O
C.铜和稀硝酸反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4 H2O
D.向次氯酸钙溶液中通入少量二氧化碳:
Ca2++2ClO-+CO2+H2O=2HClO+ CaCO3↓
1.下列说法正确的是
A.多数合金的熔点一般比组成合金的各成分金属高
B.变色玻璃中的一种是含有溴化银和微量氧化铜的玻璃
C.红宝石、蓝宝石和金刚石都是由碳元素组成的宝石
D.光导纤维的主要成分是硅,可广泛用于通信和医疗领域
31.(15分)某校学生小组为探究乙酸、碳酸和苯酚的酸性强弱并证明乙酸为弱酸,进行下述实验。
I.探究乙酸、碳酸和苯酚的酸性强弱关系。
该校学生设计了如下实验装置(夹持仪器已略去)。
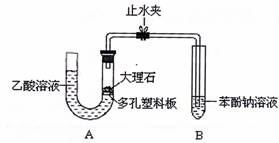
(1)实验前如何检查装置A的气密性? 。 ;大理石与乙酸溶液反应的化学方程式为 。
(2)装置A中反应产生的气体通入苯酚钠溶液中,实验现象为 ,反应的离子方程式为 。
(3)有学生认为(2)中的实验现象不足以证明碳酸的酸性比苯酚强,原因是 ,改进该装置的方法是 。
II.证明乙酸为弱酸。
(4)现有pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸。 。
30.(15分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。
请回答:
(1)乙的电子式为 。
(2)甲具有不稳定性,其发生分解的化学反应方程式为 ,实验室保存甲的方法是 。
(3)在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知△H>0。达到平衡状态后,改变其中一个条件X,的变化符合图中曲线的是 (选填字母)
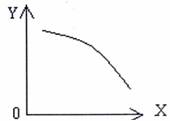
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体的密度
d.当X表示乙的物质的量时,Y表示某一生成物的物质的量
(3)现有硫酸和甲的混合液20mL,其中硫酸的物质的量浓度为2mol ·L-1,甲的物质的量浓度为1mol·L-1。向该混合液加入0.96g铜粉,假设只生成一种无色气体,则所收集到的气体的体积在标准状况下为 。
(4)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是“结合离子方程式简要说明” 。
29.(9分)A、B、C、D是原子序数由小到大的四种短周期元素。已知C和D可形成化合物X,A和B可形成化合物Y,将少量X和过量Y一起放入水中,可放出一种无色无嗅的气体单质,同时得到一种无色澄清的溶液。向此溶液中滴加过量X的水溶液时,可生成一种白色胶状沉淀物Z(Z与Y的相对分子质量相等),过滤后得到一种无色澄清溶液,其中含G,G在焰色反应中火焰呈黄色,向G的水溶液中加入酸化的硝酸银溶液时,能生成一种白色沉淀物,根据以上推断,请完成下列填空:
(1)X的化学式是 ,Y的化学式是 。
(2)4molX与6molY在水溶液中发生反应的化学方程式为 。
(3)生成白色胶状沉淀物Z的离子方程式为 。
28.(14分)X、Y、Z和W代表序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②X分别与Y、Z、W可组成化学式为YX3,X2Z和X2W三种共价化合物
请填空:
(1)X、Y、Z原子最外层电子数之和是 。
(2)X2W的电子式是 ;YX3、X2Z和X2W形成的晶体类型都属于 。
(3)X、Y和Z组成的一种化合物是强酸。写出该酸的稀溶液与铜反应的离子方程式:
X、Y和Z组成的另一种化合物是离子化合物,该离子化合物在210℃分解生成一种只含Y、Z气体和一种只含X、Z的液体(在常温、常压下)。已知40g该离子化合物完全分解可生成11.2L的气体(标准状况下),该气体的化学式为: 。
(4)X、Y、Z和W组成一种化合物,其原子个数之比为5:1:3:1;该化合物具有还原性。
①写出该化合物与过量稀NaOH溶液反应的离子方程式: 。
②请设计实验证明该化合物具有还原性: 。
27.(13分)A、B、C、D为常见氧态单质。已知:
①A和B可以在放电条件下发生化合反应,其产物还可以与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子。
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
请回答:
(1)C和D反应生成的化合物的电子式是 。
(2)上述②中化合物的热稳定性 强于 。(填写化学式)
(3)将D通入B、C生成的化合换中,发生反应的化学方程式 。
(4)A、C、D所含元素可组成一种离子化合物,该化合物发生水解反应的离子方程式 。
26.甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是 。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途 。
(3)在一定条件下,甲与O2反应的化学方程式是 。
(4)丁的元素符号是 ,他的原子结构示意图为 。
(5)丁的氧化物的晶体结构与 的晶体结构相似。
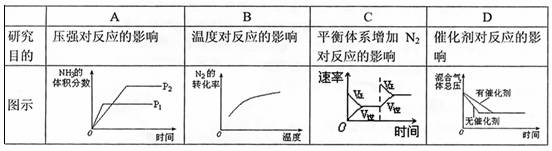
25.对于可逆反应N2(g)+3H2(g) 2NH3(g);△H<0,下列的和图示相符的是( )
2NH3(g);△H<0,下列的和图示相符的是( )
24.下图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒和酸没有接触而稀硫酸又不够,为使反应顺利进行,则可以从漏斗中加入的试剂是 ( )
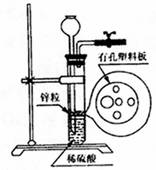
①食盐水②KNO3溶液③适量稀硫酸铜溶液④Na2CO3溶液⑤CC14⑥浓氨水
A.①③⑤ B.②⑥
C.③⑤ D.①②④
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com