
6.“纳米技术”广泛地应用于催化及军事科技中。“纳米材料”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是( )
A.能全部透过半透膜 B.有丁达尔效应
C.所得液体一定能导电 D.所得物质一定为悬浊液或乳浊液
5.以下实验装置一般不用于分离物质的是
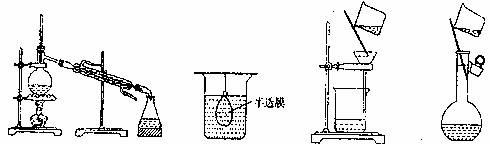
A B C D
4.在单质的晶体中一定不存在 ( )
A.共价键 B.阴、阳离于间的静电作用
C.分子间作用力 D.金属离子和自由电子间的作用
3.下列关于铜电极的叙述,正确的是 ( )
A.铜锌原电池中铜为正极,发生氧化反应
B.用电解法精练粗铜时,粗铜作阴极
C.在镀件上电镀铜时,可用精铜作阳极
D.电解稀硫酸制H2和O2时,可用铜作阳极
l.下列式子中,真实表示分子组成的是 ( )
A.H2SO4 B.NH4Cl C.SiO2 D.C
2.下列说法正确的是 ( )A.在中和热测定实验中,可用 50mL0.5mol/L的盐酸和50mL0.5moI/L的NaOH
溶液在隔热、密封性能好的装置中反应来测量
B.在稀溶液中酸和碱反应的中和热都相等
C.将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
D.由“C(石墨)→C(金刚石):△H=+1.9KJ·mol-1”可知石墨比金刚石稳定
29.(8分)在一定条件下,NO跟NH3可以发生反应生成N2和H2O。现有NO和NH3的混合物1mol,充分反应后所得产物中,若经还原得到的N2比经氧化得到的N2多1.4g。
(1)写出反应的化学方程式并用双线桥标出电子转移方向和数目。
(2)若以上反应进行完全,试计算原反应混合物中NO与NH3的物质的量各是多少?
28.(5分)A、B、C、D、E均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
|
阳离子 |
Na+ Mg2+ Al3+ Ba2+ Fe3+ |
|
阴离子 |
OH- Cl- 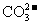 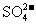 HCO3- HCO3- |
分别取它们的水溶液进行实验,结果如下:
①A溶液分别与其他四种溶液反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
据此推断它们是A ;B ;C ;D ;E 。
27.(10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ-Ⅳ所示。
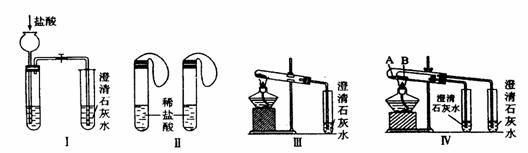
(1)只根据图I、II所示实验,能够更好的达到实验目的是(填装置序号)__________;
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为_____ ;与实验III相比,实验IV的优点是(填选项序号)_______________;
A.IV比III复杂 B.IV比III安全 C.IV比III操作简便
D.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 : 1时,所得溶液中溶质的化学式为_________,请设计实验检验所得溶液中溶质的阴离子 。
26.(Ⅰ)(6分)采用惰性电极从NO3-、SO42-、Cl-、Cu2+、Ba2+、H+中选出适当的离子组成电解质,并对其溶液进行电解(少写多写均不得分)。
(1)若两极分别放出H2和O2,则电解质的化学式为 ;
(2)若阴极析出金属,阳极放出O2,则电解质的化学式为 ;
(3)若两极分别放出气体,且体积比为1:1,则电解质的化学式为 。
(Ⅱ)(10分)按要求完成下列反应的化学方程式:
(1)工业上用硫铁矿作原料,制取硫酸 ; ; 。
(2)用氯化铁溶液溶解电路板上的铜(写离子方程式) 。
(3)将鸡蛋壳投入醋酸(写离子方程式) 。
(Ⅲ)(6分)白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。
(1)白磷是__________________晶体,31g白磷与足量的氧气完全燃烧释放出745.5kJ的热量,请写出白磷燃烧的热化学反应方程_
(2)已知白磷和氯酸溶液可发生如下反应:
□P4 +□HClO3 +□ --□HCl +□H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______________。
25.向100 mL FeBr2 溶液中通入标准状况下的 Cl2 3.36 L ,Cl2全部被还原,测得溶液中
c(Br-)=c(Cl-),则原 FeBr2 溶液的物质的量浓度是
A.0.75 mol/L B.1.5 mol/L C.2 mol/L D.3 mol/L
第Ⅱ卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com