
3.0.3 mol硼烷(B2H6)在氧气中完全燃烧生成B2O3固体和液态水,放出649.5 kJ热量。下列判断正确的是 ( )
A.该反应是非氧化还原反应
B.在理论上可以利用该反应的原理做成燃料电池
C.该反应的热化学方程式为:B2H6(g)+3O2(g)= B2O3(s) +3H2O(l); H= +2165 kJ/mol
H= +2165 kJ/mol
D.每生成18 g水,该反应转移2 mol电子
2.分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是( )
①根据酸分子中含有的氢原子个数将酸分为一元酸、二元酸等;
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应;
③根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液;
④根据反应中的热效应将化学反应分为放热反应和吸热反应
A.①② B.③④ C.①③ D.②④
1.生活中常用到一些化学知识,下列分析中正确的是 ( )
A.医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于水
B.氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性
C.某雨水样品放置一段时间后pH由4.68变为4.28,是因为水中溶解的CO2增多
D.误食重金属盐会中毒,是因为重金属盐能使蛋白质盐析
25.(8分)假设空气中含有1/5体积的氧气,且能够全部参加燃烧反应,本题所涉及和求算的气体体积都是在101℃、1.05×105Pa条件下的体积。
某常温下为气态的烯烃A混入空气后,当平均相对分子质量达到28.9375时正好使该烯烃完全燃烧。现有甲、乙两种混合气体各89.00L,甲是上述烯烃A与过量空气的混合气体,乙是上述烯烃A、某常温下为气态的炔烃B与过量空气的混合气体,将甲、乙分别引燃完全燃烧,乙燃烧后的气体变为90.00L。
(1)A的分子式为 ,若设该烯烃为CnH2n,试写出求算咒的计算式:
。
(2)甲混合气体燃烧后的体积为 。
(3)通过计算求出乙中炔烃的分子式和体积 。
(4)求出乙气体中含A的最大体积。
24.(10分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)F 2SO3(g);△H<0。当反应进行到时间
2SO3(g);△H<0。当反应进行到时间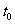 时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
(1)在下图中作出反应混合物中各组分气体的物质的量随反应进行到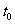 时的变化曲线。
时的变化曲线。
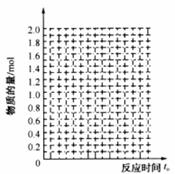
(2)当反应进行到t1时间时(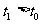 ),给上述反应容器加热到温度为T2(T2>T1),反应在t3时间时(
),给上述反应容器加热到温度为T2(T2>T1),反应在t3时间时(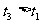 )重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1 mol(填“<”、“>”或“=”).
)重新达到平衡状态,新平衡混合物中气体的总物质的量 2.1 mol(填“<”、“>”或“=”).
(3)若起始时加入0.6 mol SO2,0.3 mol O2和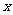 mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,
mol SO3,保持温度不变,达到平衡状态后,各气体的体积分数与上述平衡状态相同,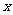 的值为
。
的值为
。
23.(10分)杀灭菊酯是一种高效、低毒的农药,其合成路线如下:
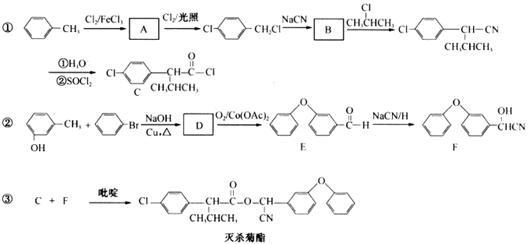
回答问题:
(1)A的分子式为 ;D的结构简式为 。
(2)D→E的有机反应类型是 反应;E→F的有机反应类型是
反应。
(3)E有多种同分异构体,请写出与E属于不同类型且含有两个苯环的,并且不能与FeCl3溶液发生显色反应的两种同分异构体的结构简式: 。
(4)完成C+F反应的化学方程式: 。
22.(8分)2005年诺贝尔化学奖授予法国的伊夫·肖万和美国罗伯特·格拉布、理查德·施罗克,以表彰他们在烯烃复分解反应研究领域作出的卓越贡献。烯烃复分解反应如下所示(炔烃也能发生此类反应):
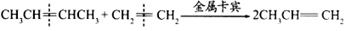
即从总效果看,是双键断裂后部分重新组合。
(1)以下反应不属于烯烃复分解反应的是 (填序号)。
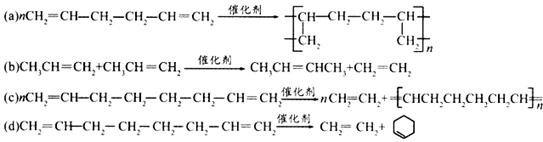
(2)写出丙炔与丙炔发生复分解反应的化学方程式: 。
(3)烯烃复分解反应可以合成其他反应难以合成的物质,写出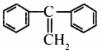 制取
制取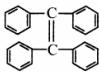 的化学方程式:
。
的化学方程式:
。
(4)人们在20世纪50年代已发现了烯烃复分解反应,到了70年代由伊夫·肖万揭示了反应机理,并制得了钛、钨、钼等金属卡宾。烯烃复分解反应有着广阔的应用前景,则后两位化学家所作的贡献应是 (填序号,多项选择)。
A.找到了更价廉的金属卡宾
B.找到了在更多化学环境都有催化活性的金属卡宾
C.使反应原理转化为实际应用
21.(10分)(I)“汽车尾气污染”已备受世人关注。汽车内燃机中,汽油汽化后与空气按 一定比例混合进入气缸,引擎用电火花点燃。燃烧使气缸内温度迅速升高,气体体积急速膨胀,产生压力推动活塞。燃烧时产生的有害气体通过尾气排出污染大气。为简化讨论,以辛烷(C8H18)代表汽油的成分,并设空气中氧气占l/5体积。请回答下列问题:
(1)设辛烷气与空气的体积比(相同条件下)为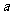 ,要使辛烷正好完全燃烧,
,要使辛烷正好完全燃烧,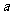 的值为
的值为
(用小数表示,设此量为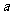 );
);
(2)若辛烷气与空气的体积比大于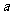 ,则尾气所含污染大气的有害气体中,相对含量会增多的是(写化学式)
,产生这种气体的化学反应方程式是
,则尾气所含污染大气的有害气体中,相对含量会增多的是(写化学式)
,产生这种气体的化学反应方程式是
。
(3)若辛烷气与空气的体积比小于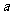 ,则尾气所含污染大气的有害气体中,相对含量会增多的是(写化学式)
,产生这种气体的化学反应方程式是
,则尾气所含污染大气的有害气体中,相对含量会增多的是(写化学式)
,产生这种气体的化学反应方程式是
。
(Ⅱ)汽车尾气造成的环境问题是“光化学烟雾”。
(1)光化学烟雾形成的化学过程是:当汽车尾气产生的NO2在日光(紫外线)照射下分解为NO和氧原子时,即开始光的化学烟雾的循环,不断产生O3,这个循环包括了下列3个化学方程式,请补充化学方程式②。
①NO2==NO+O;② ;③O+O2==O3。
写出以上3个化学反应的净结果(化学反应总反应式) 。
(2)汽油的主要成分是烷烃,在燃烧不完全时,部分烷烃热裂。试写出由热裂产物2一丁烯被臭氧氧化生成乙醛(烟雾物质之一),并释放出氧气的化学方程式:
。
(Ⅲ)2006年1月1日,“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺人一定比例的乙醇,以代替一部分汽油。下列关于乙醇汽油的说法不正确的是( )
A.乙醇汽油是一种清洁能源,燃烧不会产生污染
B.使用乙醇汽油有助于促进粮食(特别是陈粮)转化,提高农民收入,促进经济发展
C.使用乙醇汽油可大大降低油料价格
D.乙醇是二级能源,也是一种可再生能源
E.乙醇与汽油组成元素相同,化学成分相似
F.乙醇汽油燃烧时,耗氧量高于等质量的汽油
20.(10分)X、Y、Z三种短周期元素,它们的原子序数之和为16,X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化。
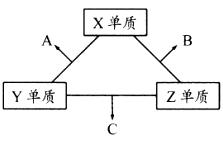
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。 请回答下列问题:
(1)X元素在周期表中的位置是 周期 族。
(2)分析同主族元素性质的递变规律,发现B、C物质的沸点反常,这是因为它们的分子之间存在 。
(3)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“于小”或“等于”),其原因是(写出离子方程式)
。
(4)已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,C的体积分数增大
19.(8分)Ⅰ.已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得溶液呈酸性;0.01 mol·L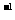 的HIO3或HMnO4溶液与Ph=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
的HIO3或HMnO4溶液与Ph=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。
(1)H5IO6是 (填“强电解质”或“弱电解质”)。
(2)已知H5IO6和MnSO4在溶液中反应生成高锰酸、碘酸和硫酸,此反应中氧化剂是
(填化学式),反应的离子方程式为 。
Ⅱ.某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B==H++HB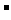 , HB
, HB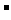
 H++B
H++B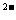 。回答下列问题:
。回答下列问题:
(1)Na2B溶液显 (填“酸性”,“中性”,或“碱性”),理由是
(用离子方程式表示)。
(2)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2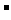 )+c(HB
)+c(HB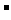 )+C(H2B)=0.1 mol/L
)+C(H2B)=0.1 mol/L
B.c(OH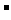 )=c(H+)+c(HB
)=c(H+)+c(HB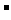 )
)
C.c(Na+)+C(H+)=c(OH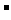 )+c(HB
)+c(HB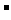 )+2c(B2
)+2c(B2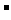 )
)
D.C(Na+)=2c(B2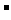 )+2c(HB
)+2c(HB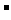 )
)
(3)已知0.1 mol/L NaHB溶液的Ph=2,则0.1 mol/L H2B溶液中氢离子的物质的量浓度可能是 0.11 mol/L(填“<”、“>”、或“=”),理由是
。
(4)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com