
5.下列说法正确的是
A.苯酚、淀粉KI、乙酸、氢氧化钾四种溶液可用FeCl3溶液一次鉴别
B.CH3CH2OH、CH2==CHCOOH、CH3CHO、CH3COOH四种溶液可用新制Cu(OH)2一次鉴别
C.CaCl2溶液中混有少量HCl,可加入过量的CaO,再过滤
D.KCl溶液中混有少量KI,可通入足量Cl2后,再用乙醇进行萃取、分液
4.在烧杯甲中放入20g Na2O2,在烧杯乙中放入20g氢氧化钡晶体与氯化铵的混合物, 分别加入20 mL水,充分搅拌,使它们溶解,然后把盛有少量乙醚液体的试管浸入烧杯甲的溶液中,用明火接近试管口,能产生黄色火焰,再把此试管浸入烧杯乙的溶液中,发现黄色火焰由长变短,直至熄灭,与上述两实验有联系的是
①乙醚着火点低;②Na2O2溶于水能放出大量的热;③氢氧化钡晶体与氯化铵混合会吸收大量热;④乙醚的沸点低
A.①②③ B.①③④ C.②③④ D.①②③④
3.据最新报道,科学家发现了如下反应:O2+PtF6==O2(PtF6),已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应,下列说法正确的是
A.在此反应中,O2氧化剂,PtF6是还原剂
B.O2(PtF6)中氧元素的化合价为+1价
C.在此反应中,每生成1 mol O2(PtF6)则转移1 mol电子
D.在O2(PtF6)中不存在共价键
2.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是
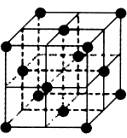
A.C60摩尔质量是720
B.C60与棒碳互为同素异形体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
1.2007年2月7日国家科技部通过了《“十一五”863计划新材料技术领域发展战略研究 报告》,明确开发新材料是国民经济和社会发展的关键。下面有关材料的说法错误的是
A.塑料、合成纤维、合成橡胶是通常所说的三大有机合成材料
B.结构陶瓷碳化硼(B4C3)常用于制造切削工具,它是一种新型无机非金属材料
C.新材料是指熔沸点高、硬度大又易于加工的材料
D.新材料可以从结构、组成、功能和应用领域等多种角度对其进行分类
1996年诺贝尔化学奖授予斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃--棒碳,它是分子中含300-500个碳原子的新物质,其分子中只含有交替连接的单键和三键。试根据上述信息回答下题:
27.(10分)为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。下表有A至I共九种气体在大气中的体积百分比及其温室效应指数。
|
选项 |
物质 |
大气中的含量(体积百分比) |
温室效应指数 |
|
A |
N2 |
78 |
0 |
|
B |
O2 |
21 |
0 |
|
C |
H2O |
1 |
0.1 |
|
D |
CO2 |
0.03 |
1 |
|
E |
CH4 |
2×10-4 |
30 |
|
F |
N2O |
3×10-5 |
160 |
|
G |
O3 |
4×10-6 |
2000 |
|
H |
CCl3F |
2.8×10-8 |
21000 |
|
I |
CCl2F2 |
4.8×10-8 |
25000 |
结合表中列出的九种气体,试参与回答下列各题:
(1)上表中A-E五种物质中,属于由极性键形成的极性分子的是 。
(2)下列说法不正确的是 。
A.N2O与CO2,CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp3方式杂化
C.CH4是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,但却是强温室气体,下列推测不正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈三角锥形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.第一电离能:N<O<F
(4)水能与多种过渡金属离子形成络合物。
已知某红紫色络合物的组成为CoCl3·5NH3·H2O。该络合物中的中心离子钴离子在基态时核外电子排布式为: ,作为配位体之一的NH3分子的空间构型为 。
26.(10分)肉桂酸甲酯(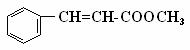 )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯的分子式是 ;
(2)有关肉桂酸甲酯的叙述中,正确的是 (填标号);
A.能与溴的四氯化碳溶液发生加成反应
B.无法使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应
D.不可能发生加聚反应
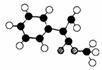
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。G的结构简式为 ;
(4)用芳香烃A为原料合成G的路线如下:
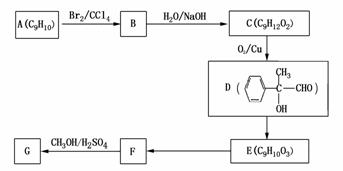
①化合物E中的官能团有 (填名称)。
②F→G的反应类型是 ,该反应的化学方程式为 。
③写出符合下列条件的F的同分异构体的结构简式 。
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
25.(9分)有机物A的结构简式为 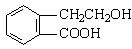 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。
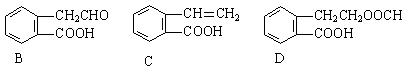
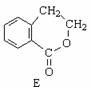
请回答下列问题:
(1)在A~E五种物质中,互为同分异构体的是 (填代号)。
(2)写出由A生成B的化学方程式和反应类型
,反应类型: 。
(3)已知HCHO分子中所有原子都在同一平面内,则在上述分子中所有的原子有可能都在同一平面的物质是 (填序号)。
(4)C能形成高聚物,该高聚物的结构简式为 。
(5)写出D与NaOH溶液共热反应的化学方程式 。
24.(12分)水体中二价汞离子可以与多种阴离子结合成不同的存在形态。水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示 [注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)]。
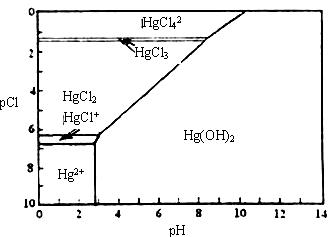
(1)正常海水(Cl-的浓度大于0.1mol/L)中汞元素的主要存在形态是 。少量Hg(NO3)2溶于0.001mol/L的盐酸后得到无色透明溶液,其中汞元素的主要存在形态是 。
(2)Hg(NO3)2固体易溶于水,但溶于水时常常会出现浑浊,其原因是 (用离子方程式表示),为了防止出现浑浊,可采取的措施是 。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
①置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为 。
②化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知:
Ksp(HgS) =1.6×10-52,当废水中c(S2-)=1×10-5mol/L时,c(Hg2+)= 。
23.(8分)已知当溶液的pH在10左右时,铝元素主要以Al(OH)3形式存在。如果饮用水中含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(Ⅱ),使其失去携氧功能;NO3-还能被水中还原性物质还原成具有强烈致癌作用的NO2-。为此世界卫生组织规定饮用水中NO3-含量(以N计)必须小于10mg/L。为了降低饮用水中NO3-的浓度,某研究人员提出以下3种方案:
a、微碱性条件下用Fe2+还原,还原产物为NH3。
b、pH=10.25时,用铝粉还原,NO3-的还原产物主要为N2。
c、在催化剂作用下用氢气还原,还原产物主要为N2。
(1)请写出a方案的相关反应的离子方程式: 。
(2)b方案中最好用 调节pH 。
A.NaOH B.CaO C.NH3·H2O
理由是 。
(3)与a、b方案相比,c方案的优点是:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com