
18.(共17分)A、B、C、D为中学化学中常见的四种气体单质。
(1)已知在空气中A约占21%、C约占78%(均为体积分数);D在标准状况下的密度为3.170g/L。分别写出A、C、D的化学式:A 、C 、D 。
SO2通入D的水溶液中,可以发生氧化还原反应,其化学方程式为:
(2)在一定条件下B与A、C、D化合分别生成甲、乙、丙。已知甲、乙分子中含有的电子数均与Na+相同;乙与丙可化合生成一种离子化合物。甲、丙的化学式是:甲 、丙 。
(3)乙可以发生如下图所示一系列转化(无关物质及反应条件已略)
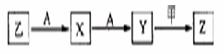
单质A与化合物乙反应的化学方程式 。Z的稀溶液与过量铁粉反应,当反应中有1.860×1024个电子转移时,被还原的Z物质的量是 mol。
(4)将B、C按体积比为3
: 1混合分别装入盛有催化剂的密闭容器I和II中(容积相同),若反应过程中容器I保持温度和压强不变,容器II保持温度和容积不变,当反应达平衡时,容器I内气体的密度 容器II内气体的密度(填“大小”、“小于”或“等于”),理由是
。在容器I中,当反应达平衡时容积变为起始时的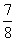 ,则C的转化率为
。
,则C的转化率为
。
17.(13分)研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题:
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
(1)解决问题①需要用到的药品有CuSO4溶液、 、 (填字母)。
A.A1C13溶液 B.NaOH溶液 C.稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是 。
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至80℃一100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在:据此可推得,X的化学式为 ,可以得出的结论是 。
(3)为解决问题③,设计了如下的实验装置(夹持及尾气处理装置未画出):
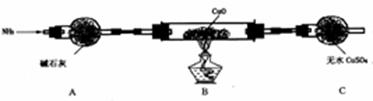
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体。装置A的作用是 ,B中发生反应的化学方程式为 。
16.有关X、Y、Z、W四种金属进行如下实验:
|
1 |
将X和Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
|
2 |
将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 |
|
3 |
用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z |
根据以下事实,下列判断或推测错误的是
A.Z的阳离子氧化性最强
B.W的还原性强于Y的还原性
C.Z放入CuSO4溶液中一定有Cu析出
D.用X、Z和稀硫酸可构成原电池,且X做负极
第Ⅱ卷(非选择题 共60分)
15.设1L pH=6的AlCl3溶液中,由水电离出的H+物质的量为n1;1L pH=6的HCl溶液中,由水电离出的H+物质的量为n2。则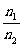 的值是
的值是
A.1 B.100 C.1000 D.10000
14.下列指定条件下的结论正确的是
A.0.1mol/L氨水中,c(OH-)=c(NH4+)
B.等物质的量浓度的盐酸和Ba(OH)2溶液等体积混合后溶液呈中性
C.在0.1mol/L CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1mol/L某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
13.把铝粉和某铁氧化物xFeO·yFe2O3粉末配成铝热剂,分成两等份。一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成的气体质量比是5 : 7,则x : y为
A.1: 1 B.1 : 2 C.5 : 7 D.7 : 5
12.下列离子方程式书写正确的是
A.铝与烧碱溶液反应:Al+2OH-=AlO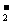 +H2↑
+H2↑
B.碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
C.CO2气体通入次氯酸钙溶液中:CO2+2ClO-+H2O=CO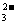 +2HClO
+2HClO
D.氯化铁溶液呈酸性:Fe3++3H2O Fe(OH)3+3H+
Fe(OH)3+3H+
11.下列各组离子一定能大量共存的是
A.在强碱溶液中:Na+、K+、AlO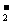 、CO
、CO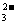
B.在含大量Fe3+的溶液中:NH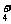 、Na+、Cl-、SCN-
、Na+、Cl-、SCN-
C.在c(H+)=10-13mol/L的溶液中:NH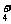 、Al3+、SO
、Al3+、SO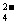 、NO
、NO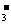
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO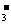
10.已知一种c(H+)=1×10-3mol/L的一元酸溶液和一种c(OH-)=1×10-3mol/L的一元碱溶液等体积混合后溶液呈碱性,生成的盐是
A.强酸强碱盐 B.强酸弱碱盐
C.强碱弱酸盐 D.上述三种盐均可能
9.已知:xA(g)+yB(g)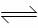 zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示。下列判断正确的是
zC(g);△H=a。将xmolA和ymolB混合在密闭容器中,在不同温度(T1>T2)及压强(P1>P2)下,C的物质的量n(C)与反应时间(t)的关系如图所示。下列判断正确的是
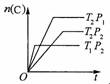
A.x+y=z;a>0 B.x+y>z;a<0
C.x+y<z;a<0 D.x+y<z;a>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com