
5.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是 ( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A. ①② B.②③ C.②④ D.③④
4.下列各组物质之间反应,调节反应用量,离子方程式不变的是 ( )
A.石灰水和SO2 B.Na[Al(OH)4]和CO2
C.Ba(OH)2溶液和H2SO4溶液 D.NaHCO3溶液和石灰水
3.设NA为阿伏加德罗常数,下列说法中正确的是 ( )
A.标准状况下,1L液态水中含有的H+数目大于10-7NA
B.足量Zn与一定量的浓硫酸反应,标准状况下产生22.4L气体时,转移的电子数为2NA
C.常温下,pH=1的醋酸溶液中,醋酸分子的数目一定大于0.1NA
D.1mol FeCl3水解生成NA胶体粒子
2.“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是( )
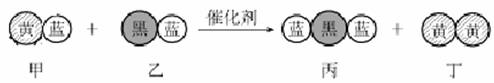
A.该反应属于氧化还原反应 B.甲和丙中同种元素化合价不可能相等
C.丁物质一定是非金属单质 D.配平后甲、乙、丙的化学计量数均为2
1.英国化学家波义耳1661年提出化学元素的概念,标志着近代化学的诞生。波义耳指出:我指的元素应当是某些不由任何其它物质所构成的原始和简单的物质或完全纯净的物质,是具有一定确定的、实在的、觉察到的实物,它们应该是用一般化学方法不能再分解为更简单的某些实物。从现代化学的观点看,波义耳定义的元素实际为 ( )
A.原子和分子 B.纯净物 C.单质 D.化合物
23.(13分)将mmolNa2O2和NaHCO3的混合物在密闭容器中加热至250℃,使其充分反应,混合物中Na2O2的物质的量分数为x。
(1)当x=1/2时,容器中固体产物 (写化学式),其物质的量为 。
(2)若反应后生成的气体为O2和H2O,则x的取值范围 。
(3)当0<x<1/3时,产生气体的物质的量n的数字表达式(用m、x表示) 。
24.(10分)用沉淀法测定NaHCO3和K2CO3混合物的组成。实验过程是每次称取一定质量的样品溶于制成溶液,向其中滴加相同浓度的Ba(OH)2溶液,每次实验均充分反应。
实验记录见下表:
|
实验次数 |
称取样品的质量/g |
所加Ba(OH)2溶液的体积/L |
测得生成沉淀质量/g |
|
1 |
0.858 |
0.5 |
1.379 |
|
2 |
1.716 |
0.5 |
|
|
3 |
2.574 |
0.5 |
4.137 |
|
4 |
3.432 |
0.5 |
5.516 |
|
5 |
4.290 |
0.5 |
5.516 |
|
6 |
5.148 |
0.5 |
5.516 |
回答下列问题:
(1)第2次实验中产生沉淀的质量是 ;
(2)Ba(OH)2溶液物质的量浓度是 ;
(3)通过计算确定样品中NaHCO3和K2CO3的物质的量之比是 。
23.(11分)
(1)高中教材中有这样一个实验:在两支试管中分别加入3mL稀盐酸,将两个分别装有0.3gNaHCO3、0.3gNa2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3、Na2CO3同时倒入试管中,观察到现象如下:
①试管中(填产生沉淀或气体及反应速率相关现象)
②两试管中气球大小(不包含试管)体积之比约为(填最简单的整数比)(盐酸均足量) ;
③甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度有升高。由此他得出:不管其状态如何,NaHCO3和HC1反应为吸热反应,而Na2CO3和HC1反应为放热反应。类似如中和热,甲同学写出了下列热化学方程式(其中“aq”代表水合成无限稀释的含义):HCO3-(aq)+H+(aq)=H2O(1)+CO2(g);△H>0 CO32-(aq)+2H+(aq)=H2O(1)+CO2(g);△H<0
甲下结论的方法是否正确 (填正确或不正确)
(2)为研究是吸热还是放热反应,继续进行了下列实验(每次实验3次平行实验,取平均值);
|
序号 |
试剂1 |
试剂2 |
混合前温度 |
混合后最高或最低温度 |
|
① |
50mL水 |
2.5gNaHCO3固体 |
20℃ |
18.5℃ |
|
② |
50mL水 |
3.2gNaHCO3固体 |
20℃ |
23.0℃ |
|
③ |
35mL稀盐酸 |
含2.5gNa2CO3的饱和溶液15mL |
20℃ |
18.8℃ |
|
④ |
35mL稀盐酸 |
含3.2gNaHCO3的饱和溶液15mL |
20℃ |
20.6℃ |
|
⑤ |
50mL稀盐酸 |
2.5gNaHCO3固体 |
20℃ |
17.4℃ |
|
⑥ |
50mL稀盐酸 |
3.2gNa2CO3固体 |
20℃ |
23.5℃ |
请你帮助填写相关内容:
该实验中所用的仪器除试管、药匙(或V型纸槽)、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器名称为 和 ;通过上述实验可得出多条结论,如:a:NaHCO3的溶解是 (吸热或放热)过程;b. Na2CO3的饱和溶液和盐酸的反应是 (吸热或放热)反应;
c. NaHCO3固体与稀盐酸反应的反应热约是 的热效应之和。
22.(14分)(Ⅰ)下面是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填编号);
(2)实验时用来精确量取液体体积的是 (填编号);
(3)使用前要检查仪器是否漏液的是 (填编号);
(4)称取10.5g固体样品(1g以下使用游码)时,将样品放在了天平的右盘,则所称样品的实际质量为 g。
(Ⅱ)实验室要用98%(p=1.84g·cm-3)的硫酸配制3.00mol-1的硫酸溶液500mL
(1)若配制3.00mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将使所配制的硫酸溶液浓度偏低的是 。
A.将稀释的硫酸液转移至容量瓶后,未洗涤烧杯和玻璃棒。
B.将烧内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用胶头滴管向容量瓶中加水时溶液凹面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
(2)若配制时,因加水不慎超过了容量瓶刻度线,此时实验如何继续进行?
21.(6分)实验室可由软锰矿(主要成分MnO2)制备KMnO4,方法如下:软锰矿与过量KOH和KC1O3在高温下反应,生成锰酸钾(K2MnO4)和KC1;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。回答:
(1)软锰矿制备K2MnO4的化学方程式是
(2)K2MnO4制备KMnO4的离子方程式是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com