
6.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或者K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的说法正确的是( )
A.Na2O2可由Na在空气中缓慢氧化得到
B.Na2O2分别与水及CO2反应生成相同量的O2时,需要的水和CO2的质量相等
C.Na2O2分别与水及CO2反应生成相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2是相同的
5.下列离子方程式正确的是 ( )
A.向次氯酸钙溶液中通入二氧化硫:Ca2++2ClO-+SO2+H2O==CaSO3↓+2HClO
B.碳酸钠水解:CO32-+H2O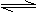 HCO3-+OH-
HCO3-+OH-
C.氯气通入水中:Cl2+H2O==Cl-+ClO-+2H+
D.氧化铁粉末投入氢碘酸溶液中:Fe2O3+6HI==2Fe2++6I-+3H2O
4.同温同压下两个容积相等的贮气瓶,一个装有C2H4和H2的混合气,另一个装有C2H6气体,两瓶内气体一定具有相同的 ( )
A.质量 B.分子总数 C.碳原子数 D.密度
3.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是 ( )
A.2.24LCO2中含有的原子总数为0.3×6.02×1023
B.4.5gSiO2晶体中含有的硅氧键数目为0.15×6.02×1023
C.5.6g铁粉与足量Cl2反应失去的电子数一定为0.15×6.02×1023
D.Na2O2固体中阴阳离子个数比为1:1
2.把金属钠投入到下列物质的溶液中,溶液质量减轻的是 ( )
A.HCl B.Na2SO4 C.FeCl3 D.NaOH
1.海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是 ( )
A.从海水可以得到NaCl,电解熔融的NaCl可制得Cl2
B.海水蒸发制海盐的过程中只发生了化学变化
C.海水中含有钾元素,只需要经过物理变化就可以得到钾单质
D.利用潮汐发电是将化学能转化为电能
29.(10分)将m g有机物A的蒸气与3.2g氧气混合点燃,充分反应后生成CO、CO2和水蒸气,将生成的气体依次通过:①盛有浓硫酸的洗气瓶,②灼热的氧化铜,③饱和石灰水(设每个装置中的反应物均过量)洗气瓶,充分吸收后:①中质量增加3.60g,②中质量减小1.60g,③中质量增加8.80g。
又知m g A与碳酸钠溶液反应产生气体的体积为V1 mL,而相同质量的A与金属钠反应时,产生气体的体积为V2 mL,且V1≠V2(同温同压下测定气体体积)。A的蒸汽密度为3.393g·L−1(已换算成标准状况)。
(1)A的摩尔质量为 。
(2)m g有机物A中所含碳原子的物质的量为 ,氢原子的物质的量为 。
(3)有机物A的质量m= g。
(4)有机物A的结构简式为 。
28.(12分)已知1,2−二氯乙烷在常温下为无色液体,沸点83.5℃,密度为1.23g·cm−3,难溶于水,易溶于有机溶剂。乙醇的沸点为78.5℃。某化学课外活动小组为探究1,2−二氯乙烷的消去反应,设计了如下实验。
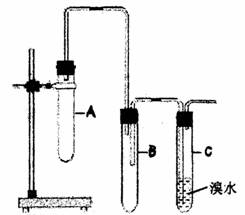
请回答下列问题:
(1)向装置A中大试管里先加入1,2−二氯乙烷和NaOH的乙醇溶液后,还需再加入 ,目的是 ,并向装置C中试管里加入适量的稀溴水。
(2)为了使反应控制在75℃左右进行,常用的方法是 。
(3)与装置A中大试管相连接的长玻璃管的作用是 ,装置B的作用是 。(4)证明1,2−二氯乙烷已发生消去反应的现象是 ,装置A、C中发生反应的化学方程式分别为:
A中: ;
C中: ;
27.(17分)有机物(C6H12)的两种异构体A、B和其它一些有机物之间有如下转化关系。其中G的一氯取代物只有两种,A的分子结构中有3个甲基。
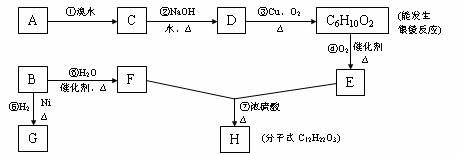
请填写下列空白:
(1)上述转化中,属于加成反应的是 (填序号)。
(2)有机物G的名称为 。
(3)有机物A和F的结构简式分别为:A 、F 。
(4)写出②③⑦三步反应的化学方程式:
② ;
③ ;
⑦ 。
(5)实验室配制银氨溶液的方法是 ,发生的有关反应的离子方程式为 、 。
26.(21分)
I:在一定条件下,反应xA+xB zC达到平衡。
zC达到平衡。
(1)若A、B、C均为气体,减压后平衡向逆反应方向移动,则x、y、z间的关系是 。
(2)已知C是气体,且x+y=z,在增大压强时,若平衡发生移动,则一定向 (填“正”或“逆”)反应方向移动。
(3)已知B、C是气体,当其他条件不变时,增大A的物质的量,平衡不移动,则A为 态。
(4)加热后C的质量分数减少,则正反应是 (填“放热”或“吸热”)反应。
II:短周期中的A、B、C、D、E5种元素,原子序数依次增大,A、D同主族;A、B的原子序数之和等于C的原子序数;C2−离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,且D、E两元素能形成微粒个数比为1︰1的离子化合物。
(1)A、B、C、D、E的元素符号依次为 、 、 、 、 。
(2)D、E元素可组成化合物甲,用石墨为电极电解甲的水溶液时,阳极的电极反应式为 ,阴极区溶液的pH 。
(3)A、C元素可组成原子个数比为1︰1的共价化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为 。
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L−1的X溶液与0.1mol·L−1的Y溶液等体积混合后,溶液呈碱性。请判断:
①X的化学式为 ,Y的化学式为
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com