
21. 过碳酸钠是一种有多用途的新型氧系漂白剂,化学式可表示为aNa2CO3·bH2O2。现将一定质量的过碳酸钠粉末溶于水配成稀溶液,再向其中加入适量MnO2粉末,充分反应后生成672mL气体(标准状况)。反应后的混合物经过滤、洗涤后,将滤液和洗涤液混合并加水配成100mL溶液A。现向三份体积为10mL、浓度为cmol/L的稀硫酸中分别逐滴滴入溶液A,边滴边振荡,充分反应后,测得实验数据如下表所示:
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
滴加溶液A的体积/mL |
5.0 |
10.0 |
15.0 |
|
生成气体的体积/mL(标准状况) |
44.8 |
89.6 |
112 |
⑴稀硫酸的物质的量浓度c= 。
⑵通过计算确定过碳酸钠的化学式。
⑶工业上常以所含活性氧的质量分数[w(活性氧)=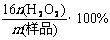 ]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL
1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L
Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
]来衡量过碳酸钠产品的优劣,13%以上者为优等品。现将0.2g某厂家生产的过碳酸钠样品(所含杂质不参与后面的氧化还原反应)溶于水配成溶液,加入15.0mL
1mol/L硫酸,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用0.1mol/L
Na2S2O3溶液滴定到蓝色恰好消失时,共消耗33.00mL,试计算判断该样品是否为优等品。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
20.(共14分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
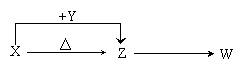
请回答:
(1)W的结构式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置V中可收集到一种无色气体。
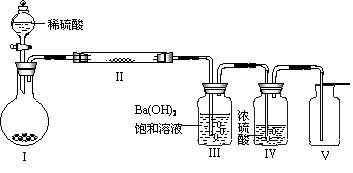
①装置Ⅰ中反应的化学方程式是 。
装置Ⅱ中物质的电子式是 。
②用Ⅹ含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要的装置,填写编号)。
(4)向Z溶液中通入氯气,生成了三种盐,其中一种为生产和生活中常用的漂白、消毒的物质,一种为X,该反应的化学方程式是 。
19.(共12分)元素A-D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质 结构 信息 |
单质制成的高压灯,发出的黄光透雾力强、射程远。 |
工业上通过分离液态空气获得其单质。 |
单质常温、常压下是气体,原子的L层上的电子是内层电子数的3.5倍。 |
+2价阳离子的核外电子层排布与氖原子相同。 |
⑴上表中与A属于同一周期的元素的符号是 ;
⑵写出D和C形成的化合物的电子式: 。
写出C单质与水反应的化学方程式
⑶对元素B及其单质的描述正确的是 。
a. B元素的最高正价为+6
b. 常温、常压下单质难溶于水
c. 单质分子中含有18个电子
d. 在一定条件下镁条能与单质B反应
⑷A和D两元素金属性较强的是(写元素符号) 。写出能证明该结论的一个实验事实 。
18.(共8分)2008年9月25日 “神州七号” 宇宙飞船顺利升空,中国航天事业取得重大发展。试回答下列有关问题:
(1)联氨(N2H4)是航天飞船常用的高能燃料。联氨是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出表示其溶于水呈碱性原因的离子方程式: 。
(2)联氨也可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种盐和水,写出其反应的化学方程式 。
(3)火箭推进器中盛有强还原剂液态联氨(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。
①反应的热化学方程式为 。
②此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
。
17.(共10分)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
⑴请将Au2O3之外的反应物与生成物分别填以下空格内。

⑵反应中,被还原的元素是 ,还原剂是 。
⑶将氧化剂与还原剂填入下列空格中,并用单线桥标出电子转移的方向和数目。

(氧化剂) (还原剂)
⑷纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为 。
16、LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:
FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含U导电固体为电解质。下列有关LiFePO4电池说法正确的是
A.可加入硫酸以提高电解质的导电性
B.放电时电池内部Li+向负极移动.
C.充电过程中,电池负极材料的质量减少
D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
第II卷 ( 非选择题,共52分)
15.若以M表示水的摩尔质量(g/mol),V是水蒸气换算为标准状况下的摩尔体积(L/mol),ρ是换算为标准状况下水蒸气的密度(g/L),NA为阿伏加德罗常数,m和α分别表示每个水分子的质量(g)和体积(L),下面四个关系式的判断正确的是:
①NA = Vρ/m ②ρ= M/(NAα) ③m =M/NA ④α=V/ NA
A.①和②都正确 B.①和③都正确
C.③和④都正确 D.①和④都正确
14.下列说法中正确的是
A.在相同条件下,若将等量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由“C(石墨)=C(金刚石);ΔH = +119kJ·mol-1 ”可知,金刚石比石墨稳定
C.在稀溶液中:H+(aq)+OH-(aq)=H2O(l);ΔH = -57.3l kJ·mol-1,若将含0.5mol H2SO4的浓硫酸与lmol NaOH溶液混合,放出的热量大于57.31 kJ
D.在101KPa时,2g H2完全燃烧生成液态水,放出285.8 kJ 热量,氢气燃烧的热化学方程式表示为:H2(g)+1/2O2(g)=H2O(l);ΔH = + 285.8 kJ·mol-1
13.把一瓶不饱和的烧碱溶液分成4等份。保持温度不变,向4份溶液中分别加入一定量的NaOH固体、Na2O2、Na2O和Na,使溶液均恰好饱和,下列说法中正确的是
A.加入的NaOH质量一定最小
B.加入的Na2O2和Na2O的物质的量之比为1︰1
C.制成饱和溶液后,4份溶液中所含NaOH质量相同
D.加入的NaOH、Na2O2、Na2O、Na的物质的量之比为2∶1∶1∶2
12.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:
A.甲的相对分子质量比乙的相对分子质量小
B.甲的摩尔体积比乙的摩尔体积小
C.甲的分子数比乙的分子数少
D.甲中所含的原子数比乙中的所含的原子数少
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com