
4.下列除杂操作正确的是 ( )
|
|
物质 |
杂质 |
试剂 |
提纯方法 |
|
A |
苯 |
苯酚 |
溴水 |
过滤 |
|
B |
二氧化碳 |
二氧化硫 |
饱和碳酸钠溶液 |
洗气 |
|
C |
乙酸乙酯 |
乙酸 |
稀氢氧化钠溶液 |
混合振荡、静置分液 |
|
D |
蛋白质 |
蔗糖 |
饱和硫酸铵溶液 |
盐析、过滤、洗涤 |
3.用铂电极电解下列溶液,当耗电量相同时,阴极和阳极上同时都有气体产生,且溶液的pH下降的是 ( )
A.H2SO4 B.CuSO4 C.HCl D.KCl
2.下列各组离子在指定条件下,-定能大量共存的是 ( )
A.使石蕊试液变红色的溶液中:K+、Na+、CO32-、NO3-
B.在酸性高锰酸钾溶液中:Na+、NH4+、I-、Br-
C. c(H+)=10-1mol/L的溶液中:Cu2+、Al3+、SO42-、NO3-
D.水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
1.分别将下列各组物质等体积混合,在室温下剧烈振荡,静置后,能够形成均一溶液的是
( )
A.苯、碘水 B.苯酚、水 C.乙醇、水 D.乙酸乙酯、水
29.(14分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
|
溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
C6H5ONa |
|
pH |
8.8 |
8.1 |
11.6 |
10.3 |
11.1 |
11.3 |
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HClO
B.CO2+H2O +NaClO===NaHCO3+HClO
C.CO2 +H2O +C6H5ONa→NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa→Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
F.CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为_________(填数值);pH最大的是_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:______________________________;
将足量的KI溶液和AgCl固体混合搅拌,会观察到的现象是____________(填序号)
A.固体由白色变为蓝色 B.固体由白色变为黄色
C.固体由白色变为紫色 D.固体由白色变为浅黄色
请写出反应的离子方程式:_____________________________。
28.(16分)电解原理常用应于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源 极,阳极反应为 ;纯铜作 极,阴极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填序号)。
A.BaCl2,Na2CO3,NaOH,HCl
B.Na2CO3,NaOH,BaCl2,HCl
C.BaCl2,NaOH,Na2CO3,HCl
D.NaOH,Na2CO3,BaCl2,HCl
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水原理示意图。电极反应为:阳极 ,下列说法中正确的是
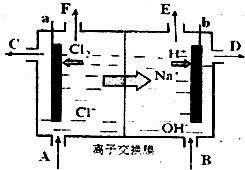
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2mol NaOH
D.向电解后的阳极室溶液中加适量盐酸,可以恢复到电解前的物质的浓度
27.(14分)由短周期元素组成A、B、C、D四种物质分别溶于水。已知:
(1)A、C的焰色反应呈黄色;
(2)取少量A、B、D溶液,分别加入BaCl2溶液,A和B中都生成白色沉淀,D没有变化;往沉淀加入稀HCl,A产生的沉淀溶解,并放出能使澄清石灰水变浑浊的无色无味的气体,则B中产生的沉淀不溶解;
(3)B、C混合加热,生成无色有刺激性气味的气体,此气体能使湿润的红色石蕊试纸变成蓝色;
(4)往D溶液中滴加C溶液,生成白色沉淀,继续滴入C,白色沉淀最终消失;
(5)在D的稀溶液中加入AgNO3溶液和稀HNO3,有白色沉淀生成;
回答下列问题:
①写出分子式:A___________,B____________,C____________,D____________。
②写出向D溶液不断滴入C溶液过程中发生反应的离子方程式: 。
③写出B、C混合加热,生成无色有刺激性气味的气体的化学方程式: 。
26.(16分)下图中A-J均代表无机物或其水溶液,其中B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。C、F的焰色反应为黄色。A为某常见金属的最高价氧化物。
根据图示回答问题:
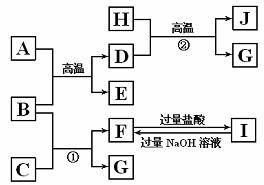
(1)写出下列物质的化学式:A ,E ,I ;
(2)反应①的化学方程式是 ;反应②的化学方程式是 。
(3)J与盐酸反应的化学方程是: 反应后的溶液与D反应的化学方程式是
(4)反应③的化学方程式
13.用48mL0.1mol/L的FeSO4溶液,恰好还原2.4×10-3mol[RO(OH)2]+离子,则R元素的最终价态为 ( )
A.+2 B.+3 C.+4 D.+5
第Ⅱ卷(非选择题,共174分)
12.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是 ( )
A.检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液
B.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液酸化
C.检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液
D.检验溶液中是否含有SO2-4时,用盐酸酸化后,加BaCl2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com