
24.(8分)如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电,则:
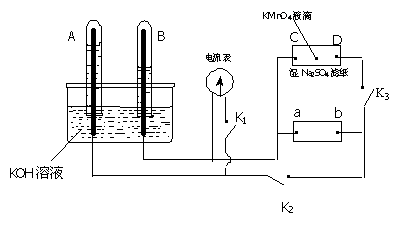
(1)标出电源的正、负极,a为______极。
(2)在湿的Na2SO4滤纸条中心的KMnO4液滴,有什么现象______________。
(3)写出电极反应式:A中_________________。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,电流表的指针偏转,则此时A极电极反应式为____________________。
23.(16分)A为药用有机物,从A出发可发生下图所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
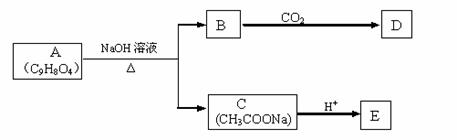
请回答:
(1)A转化为B、C时,涉及到的反应类型有_________、__________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q____________、R___________。
(3)D的结构简式为__________________。
(4)A在加热条件下与NaOH溶液反应的化学方程式为
_________________________________________________________。
(5)已知:酰氯能与含有羟基的物质反应生成酯类物质。例如:
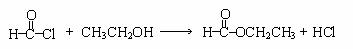 。
。
写出草酰氯(分子式C2O2Cl2,分子结构式: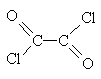 )与足量有机物D反应的化学方程式_______________________________________________________。
)与足量有机物D反应的化学方程式_______________________________________________________。
(6)已知: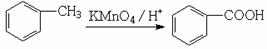
请选择适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
22.(10分)(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
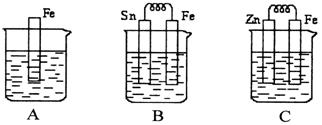
①B中Sn极的电极反应式为___________,Sn极附近溶液的pH(填“增大”.“减小”或“不变”)_______________。
②C中总反应离子方程式为________。比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是___________________。
(2)下图是甲烷燃料电池原理示意图,回答下列问题
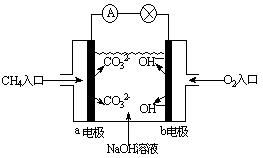
①电池的负极是_______(填a、b)该极的电极反应是:_______________
②电池工作一段时间后电解质溶液的pH______(增大、减小、不变)
21.(10分)请按要求回答下列问题。
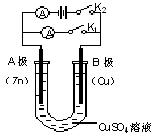
(1)根据图1回答①②
①打开K2,合并K1。
A电极可观察到的现象是_____________________;
B极的电极反应为 。
②打开K1,合并K2。
A电极可观察到的现象是 ;
B极的电极反应为 ;
(2)根据下图回答③④
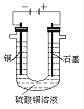
③将较纯净的CuSO4溶液放入上图所示的装置中进行电解,石墨电极上的电极反应式为_______________________, 电解反应的离子方程式为_____________;
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积___________L。
20.(10分)(1)常温下有浓度均为0.5mol·L-1的四种溶液:①碳酸钠溶液;②碳酸氢钠溶液;③盐酸;④氨水。请根据题目要求回答下列问题。
①上述溶液中,可发生水解反应的是 (填序号,下同)。
②上述溶液中,既能与氢氧化钠溶液反应,又能与硫酸溶液反应的是 。
③取适量溶液④,加入少量氯化铵固体,此时溶液中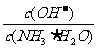 的值_________(填“增大”或“减小”或“不变”)。
的值_________(填“增大”或“减小”或“不变”)。
④ 若③和④的溶液混合后溶液恰好呈中性,则混合前③的体积(填“大于”、“小于”或“等于”,下同)___________ ④的体积。
⑤取10mL溶液③,加水稀释到500mL,则该溶液中由水电离出c(H+)=____________。
(2)温度相同、浓度均为0.2mol/L的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤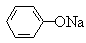 、⑥CH3COONa溶液,
、⑥CH3COONa溶液,
①它们的pH值由小到大的排列顺序是______________________
②上述含有NH4+的溶液中,NH4+浓度由大到小顺序___________
19.(4分)以下第(1)(2)小题可以有一个或多个正确的选项,填入编号。
(1)下列叙述中,正确的是___________
①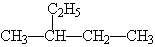 的化学名称是2-乙基丁烷
的化学名称是2-乙基丁烷
②有机物在NaOH水溶液中水解后,加AgNO3溶液有沉淀产生,则该有机物为卤代烃
③能聚合成高分子化合物的单体中都含有碳碳双键
④苯和甲苯可以用KMnO4酸性溶液鉴别
⑤天然蛋白质水解后得到的最终产物一定是α-氨基酸
(2)在有机物中(a)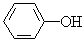 (b)CH2=CH2 (c)CH3CH(CH3)CH2OH
(b)CH2=CH2 (c)CH3CH(CH3)CH2OH
(d)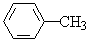 (e)CH3COOCH2CH3 (f)
(e)CH3COOCH2CH3 (f) (g)CH3CH(CH3)CH2Br
(g)CH3CH(CH3)CH2Br
①属于芳香烃的是(用数字编号表示)_____________;
②能与溴水反应的是_____________;
③能与氢氧化钠水溶液反应的是________。
18.某金属元素R的硝酸盐R(NO3)n溶液用Pt电极电解,阳极产生气体VL(标准状况)时,阴极质量增加mg,若R的原子量为M,下列叙述中不正确的是 ( )
A.电路中通过电子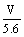 mol
B.n=
mol
B.n=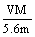
C.溶液中H+增加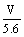 mol D.n=
mol D.n=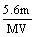
17.夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。 “魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为
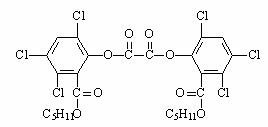 。下列有关说法正确的是
( )
。下列有关说法正确的是
( )
A.草酸二酯的分子式为C26H24Cl6O8
B.1mol草酸二酯与氢氧化钠稀溶液反应 (苯环上卤素不水解),最多消耗6molNaOH
C.草酸二酯水解可以得到两种有机物
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
16.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
15.下列说法正确的是 ( )
A.0.2mol·L-1的醋酸钠溶液中,c(Na+)=c(CH3COO- )
B.室温下,pH=3盐酸和pH=11的氨水等体积混合后的溶液pH小于7
C.向氯化钠溶液中滴加稀硝酸得到pH=5的混合溶液中,c(Na+)=c(Cl-)
D.0.1mol·L-1的碳酸钠溶液中,c(H+)-c(OH-)=c(CO32-)+c(H2CO3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com