
3.取少量无机盐溶液试样对其中的离子进行检验。下列判断正确的是 ( )
A.加入盐酸,产生白色沉淀,则试样一定有Ag+
B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-
C.加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42-
D.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有
NH4+
2.下列叙述不正确的是 ( )
A.易溶于水的物质一定是电解质
B.有化学键断裂的变化不一定是化学变化
C.熔化状态下能导电的物质不一定是离子晶体
D.水受热不易分散,与水分子之间存在的氢键无关
1.下列叙述不正确的是 ( )
A.二氧化硅是光导纤维的主要原料
B.某些药皂中含有苯酚,说明苯酚是无毒的
C.淀粉、纤维素、蛋白质属于天然高分子化合物
D.国家严禁在食品及动物饲料中添加的三聚氰胺是有机物
21.(11分)对金属表面进行处理,形成一层致密的氧化物保护膜,是非常有效的一种金属防腐技术。
I.钢铁“发蓝”是在钢铁表面形成一层致密的Fe3O4薄膜的技术。其中一种方法是将钢铁制品浸到NaNO2和浓NaOH的混合溶液中加热到130℃。其过程可以用如下化学方程式表示:
①3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
②6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH
③Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
则反应②中的氧化剂是 (填化学式),整个反应过程中,每有168 g Fe参加反应,则转移 mol电子。
|
(1)配制实验用的溶液。要配制500 mL密度为1.2 g·cm-3的溶质质量分数为16%的NaOH溶液,需要称取 g NaOH固体。
(2)把铝片浸入热的16% NaOH溶液中约半分钟左右洗去油污,除去表面的氧化膜,取出用水冲洗。写出除去氧化膜有关反应的离子方程式:
。
(3)如图,组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的电极反应式:
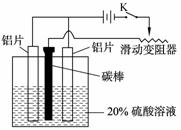
阳极: ;
阴极: 。
20.(10分)海水是人类资源宝库,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)从海水中可以提取单质溴,溴元素在海水中以 (选填“游离态”或“化合态”)的形式存在,溴元素在元素周期表中的位置为 。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (选填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。该电解反应的离子方程式为:
。
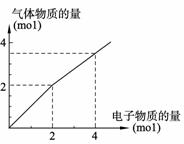
用惰性电极电解一定浓度的食盐水时,通过电子的物质的量与生成气体总物质的量的关系如下图所示(不考虑氯气的溶解)。若电解结束时,通过电子总物质的量为4 mol,电解后恢复至常温,溶液的体积为2 L,则溶液的pH为 ,混合气体中氢气的物质的量为 。
19.(12分)熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒
g.托盘天平中,标有“0”刻度的是(填序号)。 。
(2)“磨砂”是增加玻璃仪器密封性的一种处理工艺。在下列仪器中,没有用到 “磨砂”工艺处理的有(填序号) 。
a.试管 b.分液漏斗 c.带滴管的试剂瓶(滴瓶) d.集气瓶 e.酸式滴定管 f.碱式滴定管,
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:
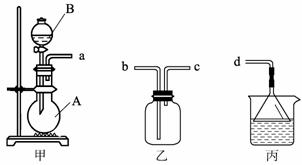
①若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。
通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为 ;
②若在乙中收集氨气,气体流经装置的顺序是:a→ → →d(填接口代号)。
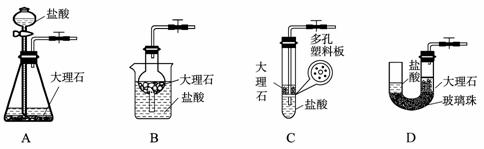
(4)下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有 (填写编号)。
18.(11分)某短周期元素A,其最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。已知乙的密度是同温同压下H2密度的8.5倍。请回答:
(1)乙的化学式为 。
(2)甲具有不稳定性,发生分解反应的化学反应方程式为 。
实验室保存甲的方法是 。
(3)298K时,将乙放入体积固定的密闭容器中使其发生分解反应(ΔH>0),当反应达到平衡状态后,改变其中一个条件X,Y随X的变化符合下图中曲线的是 (选填下列各项序号字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体的密度
d.当X表示乙的物质的量时,Y表示某一生成物的物质的量
(4)现有硫酸和甲的混合液20 mL,其中硫酸的物质的量浓度为2 mol·L-1,甲的物质的量浓度为1 mol·L-1。向该混合液中加入0.96 g铜粉,假设只生成一种无色气体,则所收集到气体的体积在标准状况下为 mL。
(5)丙对水的电离起 作用(填“抑制”、“促进”或“不影响”),原因是(用离子方程式表示) 。
17.(9分)2007年诺贝尔化学奖授予德国科学家格哈德·埃特尔,以表彰他在表面化学研究领域作出的开拓性贡献。

(1)有人认为:该研究可以提高合成氨反应在铁催化剂表面进行的效率,从而提高原料的转化率。你是否认同他的观点 (填“是”或“否”)。理由是 。
(2)合成氨反应: N2(g)+3H2(g) 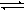 2NH3(g),在某温度时,K=0.4 L2·mol-2。
2NH3(g),在某温度时,K=0.4 L2·mol-2。
①若出现下列状态,反应将向那个方向进行以达到平衡状态(在后面空白处填“向左进行”、“向右进行”或“已达平衡状态”)?
(A)c(N2)=c(H2)=1 mol·L-1,c(NH3)=0.5 mol·L-1。
(B)c(N2) =0.3 mol·L-1,c(H2)=0.1 mol·L-1,c(NH3)=0.03 mol·L-1。
②若该反应升高温度再达到平衡时,K为0.2 L2·mol-2,则正反应为热反应。
16.(2分)随着我国家用汽车数量的迅猛增加,加速了城市空气污染。往汽油中添加10%至15%的酒精,可以减少70%以上的污染。已知每46 g酒精完全燃烧生成液态水时放出的热量为1 367 kJ。请写出酒精完全燃烧的热化学方程式:
。
15.常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:
Ksp(Ag2SO4) =7.7×10-5 mol3·L-3、Ksp(AgCl) =1.8×10-10 mol2·L-2、
Ksp (AgI)=8.3×10-17 mol2·L-2。下列有关说法中,错误的是 ( )
A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com